题目内容
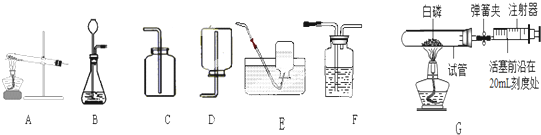
根据以下装置图,回答下列问题:
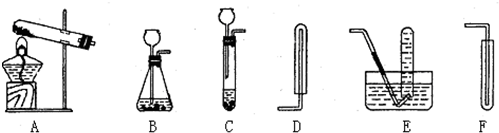
双氧水(H2O2)是一种无色液体,化学实验室用它来制取氧气,用此方法制取氧气时应选用的气体发生装置是
该化学反应方程式

双氧水(H2O2)是一种无色液体,化学实验室用它来制取氧气,用此方法制取氧气时应选用的气体发生装置是
B
B
;收集装置是E或F
E或F
.该化学反应方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
分析:据反应物状态和反应条件选择发生装置,据氧气密度和溶解性选择收集装置,据反应原理书写方程式.
解答:解:双氧水在二氧化锰的催化作用下生成水和氧气,反应不需加热,属于固液常温型,故选发生装置B,氧气密度比空气大且不易溶于水,所以可用向上排空气法或排水法收集,反应方程式是:2H2O2
2H2O+O2↑;
故答案为:B;E或F;2H2O2
2H2O+O2↑.
| ||
故答案为:B;E或F;2H2O2
| ||
点评:掌握过氧化氢制取氧气的反应方程式、会据反应物状态和反应条件选择发生装置,据氧气密度和溶解性选择收集装置即可.

练习册系列答案
相关题目