题目内容
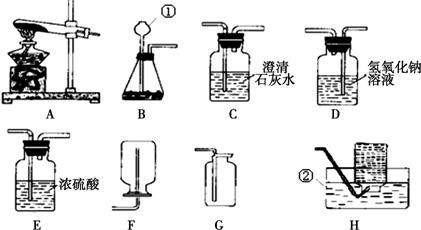
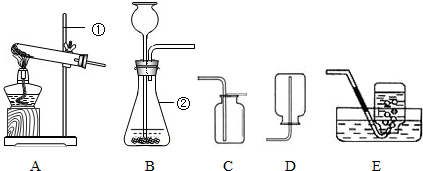
28、根据下列装置图.回答有关问题:

(1)写出装置中标号仪器的名称:①
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是
(3)写出实验室制取二氧化碳的化学方程式
属于
(4)某化学探究小组用盐酸与大理石反应研究影响反应剧烈程度的因素.实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10g;所用盐酸的质量分数为9.125%、18.25%,每次实验盐酸的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1g/cm3;大理石中杂质不与盐酸反应).
①提出假设:盐酸与大理石反应的剧烈程度与所用盐酸的质量分数、大理石规格、反应温度有关.
②实验设计与实施:完成以下实验设计方案并实验.
③实验结论:

(1)写出装置中标号仪器的名称:①
试管
;②长颈漏斗
.(2)实验室用高锰酸钾制取氧气,可选用的发生装置是
B
(填字母).(3)写出实验室制取二氧化碳的化学方程式
CaCO3+2HCl=CaCl2+CO2↑
,该反应属于
复分解
反应(填基本反应类型)根据上图组装一套制取干燥CO2的装置CDE
(用字母表示),验满的方法是将燃着的木条放在集气瓶口,木条熄灭说明已满
.(4)某化学探究小组用盐酸与大理石反应研究影响反应剧烈程度的因素.实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10g;所用盐酸的质量分数为9.125%、18.25%,每次实验盐酸的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1g/cm3;大理石中杂质不与盐酸反应).
①提出假设:盐酸与大理石反应的剧烈程度与所用盐酸的质量分数、大理石规格、反应温度有关.
②实验设计与实施:完成以下实验设计方案并实验.
| 实验 编号 |
T/℃ | 大理石 规格 |
盐酸的 质量分数 |
完全反应 的时间/s |
实验目的 |
| a | 25 | 粗颗粒 | 18.25% | 160 | (I)实验a和b探究同体积下盐酸质量分数对该反应剧烈程度的影响. (II)实验a和c探究温度对该反应剧烈程度的影响. (Ⅲ)实验a和d探究大理石规格对该反应剧烈程度的影响. |
| b | 210 | ||||
| c | 35 | 粗颗粒 | 18.25% | 60 | |
| d | 100 |
在其他条件不变时,盐酸质量分数越大,反应越剧烈;温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈.
.分析:(1)熟悉常见仪器,了解名称;
(2)根据高锰酸钾制氧气需要加热选择发生装置;
(3)实验室制取二氧化碳用稀盐酸与碳酸钙反应,制取干燥的二氧化碳只需加一个干燥装置;根据二氧化碳不支持燃烧的性质验满;
(4)②联系物理中学过的控制变量法,根据实验设计方案中的实验目的(Ⅰ)实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%.同理,实验d中的空缺应该分别是25、细颗粒和18.25%.
③根据ab盐酸质量分数的不同导致用时的不同;ac温度的不同导致用时不同;ad颗粒大小的不同导致用时不同考虑实验结论.
(2)根据高锰酸钾制氧气需要加热选择发生装置;
(3)实验室制取二氧化碳用稀盐酸与碳酸钙反应,制取干燥的二氧化碳只需加一个干燥装置;根据二氧化碳不支持燃烧的性质验满;
(4)②联系物理中学过的控制变量法,根据实验设计方案中的实验目的(Ⅰ)实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%.同理,实验d中的空缺应该分别是25、细颗粒和18.25%.
③根据ab盐酸质量分数的不同导致用时的不同;ac温度的不同导致用时不同;ad颗粒大小的不同导致用时不同考虑实验结论.
解答:解:(1)图中①是试管,②是长颈漏斗,故答案为:试管;长颈漏斗;
(2)用高锰酸钾制取氧气需要加热,所以发生装置可选A或B,但A装置中试管口缺少一团棉花,故选B.
故答案为:B.
(3)实验室用稀盐酸与碳酸钙的反应制取二氧化碳,化学反应式是:CaCO3+2HCl=CaCl2+CO2↑,此反应属于两种化合物相互交换成分,生成另外两种化合物的复分解反应;制取干燥的二氧化碳需要干燥装置,所以选有浓硫酸的装置,收集装置要用向上排空气法.故选CDE;二氧化碳的验满可根据它不支持燃烧的特点,将燃着的木条放在集气瓶口,木条熄灭说明已满.
故答案为:CaCO3+2HCl=CaCl2+CO2↑;复分解反应;CDE;将燃着的木条放在集气瓶口,木条熄灭说明已满;
(4)①联系物理中学过的控制变量法,根据实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%.同理,实验d中的空缺应该分别是25、细颗粒和18.25%.即
②根据实验a和b探究时间(即160s和210s)可知,实验a比b用时少;这就说明了实验a比b反应剧烈.也就不难得出:在其他条件不变时,盐酸质量分数越大,反应越剧烈.同理可得,在其他条件不变时,温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈.所以,该实验结论应该是:在其他条件不变时,盐酸质量分数越大,反应越剧烈;温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈.
(2)用高锰酸钾制取氧气需要加热,所以发生装置可选A或B,但A装置中试管口缺少一团棉花,故选B.
故答案为:B.
(3)实验室用稀盐酸与碳酸钙的反应制取二氧化碳,化学反应式是:CaCO3+2HCl=CaCl2+CO2↑,此反应属于两种化合物相互交换成分,生成另外两种化合物的复分解反应;制取干燥的二氧化碳需要干燥装置,所以选有浓硫酸的装置,收集装置要用向上排空气法.故选CDE;二氧化碳的验满可根据它不支持燃烧的特点,将燃着的木条放在集气瓶口,木条熄灭说明已满.
故答案为:CaCO3+2HCl=CaCl2+CO2↑;复分解反应;CDE;将燃着的木条放在集气瓶口,木条熄灭说明已满;
(4)①联系物理中学过的控制变量法,根据实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%.同理,实验d中的空缺应该分别是25、细颗粒和18.25%.即
| 实验编号 | T/℃ | 大理石规格 | HCl的质量分数 |
| b | 25 | 粗口颗粒 | 9.125% |
| d | 25 | 细颗粒 | 18.25% |
点评:此题是综合性很强的一道题,考查的点多面广.它不但考查了影响化学反应速率的因素,还考查了有关的化学方程式的书写,更考查了根据有关的实验数据推导的能力.解答此类题目时,只有抓住实验目的,结合物理中学过的控制变量法,进行细致的思考、推断,才可达到柳暗花明又一村的理想境界,最终准确无误地解答出各个问题.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目