题目内容
氧化钙和过氧化钙(CaO2)是钙的两种氧化物。过氧化钙是一种淡黄色的固体,与水反应能放出氧气,过氧化钙在受热时生成氧化钙和氧气。下列结论中,正确的是
- A.组成两种物质的元素不同
- B.两种物质的化学性质相同
- C.过氧化钙在受热时发生的反应属于分解反应
- D.过氧化钙与水反应的化学方程式为CaO2 + H2O = CaCO3↓ + O2↑
C
A、氧化钙和过氧化钙都是由钙元素和氧元素组成的,故选项错误;
B、氧化钙能与水反应生成氢氧化钙,而过氧化钙能与水反应放出氧气,故选项错误;
C、过氧化钙在受热时生成氧化钙和氧气符合分解反应的定义,故选项正确;
D、根据质量守恒定律,化学反应前后元素的质量不变,所以过氧化钙与水反应不能生成碳酸钙,故选项错误.
故选项为:C.
A、氧化钙和过氧化钙都是由钙元素和氧元素组成的,故选项错误;
B、氧化钙能与水反应生成氢氧化钙,而过氧化钙能与水反应放出氧气,故选项错误;
C、过氧化钙在受热时生成氧化钙和氧气符合分解反应的定义,故选项正确;
D、根据质量守恒定律,化学反应前后元素的质量不变,所以过氧化钙与水反应不能生成碳酸钙,故选项错误.
故选项为:C.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
【猜想】另一生成物为氢氧化钙.
【进行实验】
取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
______色,则猜想成立.写出反应的化学方程式______.
【意外发现】
较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,他们认为褪色的可能原因是______.
【查阅资料】
过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质.
实验探究二:测定久置过氧化钙纯度
【实验过程】
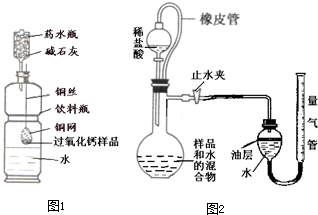
称量144g样品放在铜网中,按图1所示装置组装后(药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器
及反应后物质总质量.测得实验数据如下表.
| 样品质量 | 装置及药品总质量 | 装置及反应后物质总质量 | |
| 实验数据 | 144g | 394g | 378g |
(1)药水瓶中碱石灰的作用为______.
(2)本实验测得过氧化钙含量可能会偏小的原因是______.
(3)根据实验数据计算:①生成氧气______g.②样品中过氧化钙的含量是______.
实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性;
②精确称量一袋样品质量置于烧杯中并加入适量水混合,再全部倒入烧瓶中,并在分液漏斗中加入足量稀盐酸;
③将液面调节到量气管的“0”刻度,并使两边液面相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管两边液面相平,读出气体体积;
⑤计算样品中碳酸钙含量(CO2的密度为1.97g/L).
【问题讨论】
(4)图中油层的作用为______,油层上方留有空气,会使测量结果______(填“偏大”、“偏小”或“无影响”).中和反应放热,滴加稀盐酸后,发生装置中的中和反应的化学方程式为______.
(5)若测得量气管读数为896mL,则实验中选用的量气管规格合适的是______(填字母序号)
A、100ml B、1L C、2L
(6)测定方案的步骤4中再次调节量气管两边液面相平的方法为______.步骤2中将样品和水混合的目的是______.
(7)在充分反应后将烧瓶中的液体蒸干得到55.5g固体,求这袋样品在变质前的过氧化钙质量(写计算过程).
化学实验和科学探究都离不开实验装置.根据下列装置,回答问题:
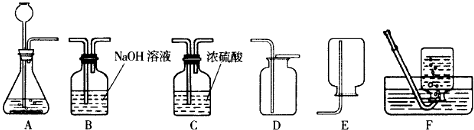
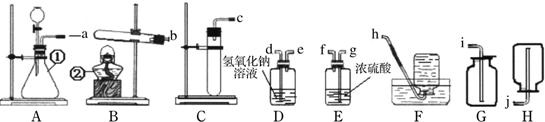
(1)用A装置制取氧气的化学反应方程式是______.实验室使用稀盐酸和金属锌制取的氢气往往含有少量______和水蒸气杂质,欲收集纯净的氢气,所选装置的顺序为______;
(2)科学探究
查阅资料:小玲同学查阅资料发现:过氧化钙(CaO2)能分别与水、二氧化碳反应.
过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑
猜想:过氧化钙在空气中久置生成的物质可能是碳酸钙或氢氧化钙或二者的混合物.
实验探究:
实验一:选用装置A进行过氧化钙与水反应的实验,收集气体;取反应后的溶液置于试管中,充分振荡后再滴入______(填写一种试剂的名称)试液,发现溶液变成红色.
实验二:为探究猜想是否正确,小玲设计了如下实验,请你帮助她完成表格中的空白内容:
| 实验步骤 | 实验现象 | 结论 |
| a.取在空气中久置的少量固体于试管中,加足量水 | 未见固体明显溶解 | |
| b.向试管中滴加几滴紫色石蕊试液 | 未见明显的颜色变化 | 不存在氢氧化钙 |
| c. | 有气泡产生 | 固体成分是碳酸钙 |
(3)在上述实验一中,若取过氧化钙(CaO2)7.2g加入足量水94.4g,充分反应,求得到溶液的溶质质量分数.