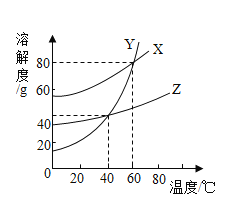
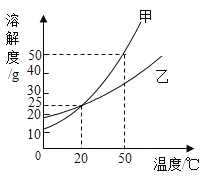
题目内容
【题目】化学兴趣小组同学为了测定烧碱的变质情况,取烧碱样品13g进行下列实验:

(1)写出上述反应的化学方程式 __________;
(2)列出求解混合物中参加反应的物质质量(X)的比例式 ______;
(3)混合物中所含物质的质量比是 _________;
(4)过滤后所得溶液的质量分数是 ____________;
(5)用这种方法制取20.8g的氢氧化钠,需要此烧碱样品的质量为 _______。
【答案】![]()
![]() 53:12 2.6% 26g
53:12 2.6% 26g
【解析】
(1)烧碱是氢氧化钠,易与空气中的二氧化碳反应生成碳酸钠和水,氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,反应的化学方程式为:![]()
(2)参加反应的氢氧化钡的质量为:100g×17.1%=17.1g
设混合物中参加反应的物质质量x,生成氢氧化钠的质量为y,生成碳酸钡的质量为z,
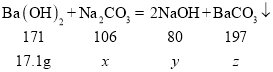
混合物中参加反应的物质质量(x)的比例式为:![]()
(3)根据比例式计算可得混合物中碳酸钠的质量为10.6g,氢氧化钠的质量为:13g-10.6g=2.4g,混合物中碳酸钠和氢氧化钠的质量比为:10.6:2.4=53:12;
(4)![]() y=8.0g
y=8.0g
![]() z=19.7g
z=19.7g
反应后溶质包括原混合物中的氢氧化钠和生成的氢氧化钠,质量为:2.4g+8.0g=10.4g
溶液的质量为:200g+100g+13g+106.7g-19.7g=400g
过滤后所得溶液的质量分数是![]()
(5)根据以上分析知,每13g此样品制得氢氧化钠的质量为10.4g,制取20.8g的氢氧化钠,需要此烧碱样品的质量为:![]() 。
。

练习册系列答案
相关题目