题目内容
【题目】某化学小组为测定大理石中碳酸钙的含量,称取大理石样品25.0g,分成五等份于5个烧杯中进行实验,记录有关实验数据如下表所示(大理石中其它成分均不溶于水,也不参加反应),计算:
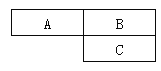
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入大理石样品的质量/g | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 |
加入稀盐酸的质量/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
烧杯中剩余固体的质量/g | 4.0 | 3.0 | 2.0 | 1.0 | 1.0 |
(1)样品中碳酸钙的质量是 。
(2)所用稀盐酸的溶质质量分数。
【答案】4.0g;7.3%
【解析】
(1) 前四次每加入10.0g盐酸导致固体质量减少1.0g也就是每10.0g盐酸和1.0g碳酸钙反应,到第五次时固体不再减少,说明杂质的质量为1.0g,碳酸钙的质量为4.0g;
(2) 根据每10.0g盐酸和1.0g碳酸钙恰好完全反应求算稀盐酸的溶质的质量分数,设稀盐酸中溶质的质量分数为x,
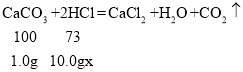
![]()
x= 7.3%,
答:(1)样品中碳酸钙的质量是 4.0g,
(2)所用稀盐酸的溶质质量分数为7.3%。

练习册系列答案
相关题目