题目内容
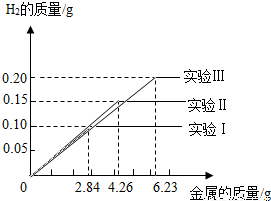
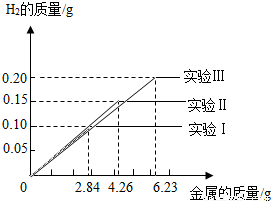
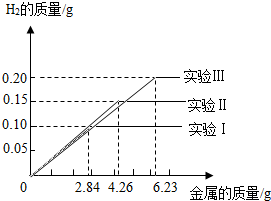 某化学小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份铁合金样品(假设样中只含铁和碳),在三份样品中分别加入94.6g稀硫酸中进行实验(实验编号I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象试回答:
某化学小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份铁合金样品(假设样中只含铁和碳),在三份样品中分别加入94.6g稀硫酸中进行实验(实验编号I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象试回答:(已知生铁含碳2%~4.3%,钢含碳0.03%~2%)
(1)实验I中参加反应的铁质量为
(2)实验Ⅱ中参加反应的硫酸质量是
(3)实验
分析:(1)由实验数据图象,完全反应放出氢气质量为0.10g,根据氢气质量计算参加反应铁的质量,通过计算含碳量判断样品的种类;
(2)根据反应放出氢气质量0.15g,计算参加反应的硫酸的质量;
(3)对比钢铁样品质量与放出氢气质量的关系,判断稀硫酸参加反应的情况;并计算稀硫酸完全反应时,生成硫酸亚铁的质量,计算出生成硫酸亚铁与所得溶液的质量比.
(2)根据反应放出氢气质量0.15g,计算参加反应的硫酸的质量;
(3)对比钢铁样品质量与放出氢气质量的关系,判断稀硫酸参加反应的情况;并计算稀硫酸完全反应时,生成硫酸亚铁的质量,计算出生成硫酸亚铁与所得溶液的质量比.
解答:解:(1)设参加反应的铁质量为x
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
56:2=x:0.10g 解之得 x=2.8g
2.84g钢铁样品中含C量=
×100%≈1.4%<2%
故答案为:2.8(1分);钢(1分);
(2)设参加反应的硫酸质量为y
Fe+H2SO4=H2↑+FeSO4
98 2
y 0.15g
98:2=y:0.15g 解之得 y=7.35g
故答案为:7.35(1分)
(3)2.84g钢铁样品完全反应放出氢气质量为0.10g,
那么,6.23g钢铁样品完全反应放出氢气质量=
×0.10g≈0.22g
而第III次实验中得到氢气质量为0.2g<0.22g,钢铁样品未完全反应,则稀硫酸完全反应;
故答案为:Ⅲ(1分);
设铁和硫酸亚铁的质量分别是x、y
Fe+H2SO4=H2↑+FeSO4
56 2 152
x 0.2g y
=
解之得 x=5.6g
=
解之得 y=15.2g
反应后溶液中溶质的质量分数=
×100%=15.2%
答:反应后溶液中溶质的质量分数为15.2%.
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
56:2=x:0.10g 解之得 x=2.8g
2.84g钢铁样品中含C量=
| 2.84g-2.8g |
| 2.84g |
故答案为:2.8(1分);钢(1分);
(2)设参加反应的硫酸质量为y
Fe+H2SO4=H2↑+FeSO4
98 2
y 0.15g
98:2=y:0.15g 解之得 y=7.35g
故答案为:7.35(1分)
(3)2.84g钢铁样品完全反应放出氢气质量为0.10g,
那么,6.23g钢铁样品完全反应放出氢气质量=
| 6.23g |
| 2.84g |
而第III次实验中得到氢气质量为0.2g<0.22g,钢铁样品未完全反应,则稀硫酸完全反应;
故答案为:Ⅲ(1分);
设铁和硫酸亚铁的质量分别是x、y
Fe+H2SO4=H2↑+FeSO4
56 2 152
x 0.2g y
| 56 |
| 2 |
| x |
| 0.2g |
| 2 |
| 152 |
| 0.2g |
| y |
反应后溶液中溶质的质量分数=
| 15.2g |
| 5.6g+94.6g-0.2g |
答:反应后溶液中溶质的质量分数为15.2%.
点评:根据质量守恒定律,反应后溶液中溶质的质量=参加反应铁的质量+参加反应稀硫酸的质量-反应放出氢气的质量.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
某化学小组的同学到钢铁厂做社会调查.他们抽取组成相同、质量不同的三份钢的样品(假设钢的样品中只含铁和碳),分别加入100g 19.6%的硫酸进行实验(见下表),充分反应后,用得到的实验数据绘制出如图所示的图象.
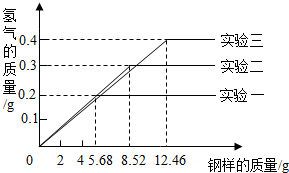
试回答:
(1)实验一中参加反应的铁的质量为多少克?
(2)稀硫酸完全反应的实验中,反应后所得溶液中溶质的质量分数是多少?
| 实验序号 | 钢样的质量/g | 19.6%硫酸的质量/g |
| 一 | 5.68 | 100g |
| 二 | 8.52 | 100g |
| 三 | 12.46 | 100g |

试回答:
(1)实验一中参加反应的铁的质量为多少克?
(2)稀硫酸完全反应的实验中,反应后所得溶液中溶质的质量分数是多少?