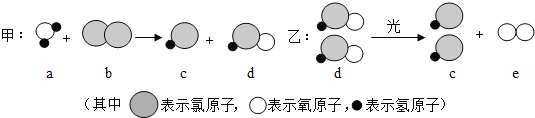
��Ŀ����
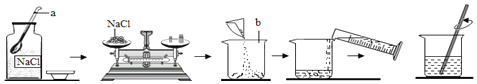
����Ŀ��С��ͬѧ����һ�����������������Ȼ�����Һ������ʵ��ʱ�������ƹ�����ͼ��ʾ��
�Իش��������⣺
��1��д��ͼ���б�����������ƣ�a_____��b_____��
��2��ͼʾʵ������һ�����ԵĴ�����_____��ͼʾʵ���в�������������_____��
��3��С��ͬѧҪ����100g��������6%Ϊ���Ȼ�����Һ��Ӧ��ȡ�Ȼ��Ƶ�����Ϊ_____ g����Ҫˮ_____mL��ˮ���ܶ�Ϊ1g/mL������Ͳ�Ĺ��ӦΪ_____������50mL������100mL����
��4�����ڳ����Ȼ���ʱ����С�İ������ҩƷ�ŷ��ˣ������������Ϊ5.0g���������Ϊ1.0g����Ƶõ��Ȼ�������ʵ��Ϊ_____g������ȡˮ�����ʱ��С��ͬѧ���Ӷ���������������Һ���Ȼ��Ƶ���������_____������ƫ������ƫС����������������
���𰸡�ҩ�� �ձ� �Լ�ƿ������ ��������ܽ� 6 94 100mL 4.0 ƫ��
��������
��1������a��ҩ�ף�b���ձ������ҩ�ף��ձ���
��2��ͼʾʵ������һ�����ԵĴ������Լ�ƿ�����ţ�Ϊ��ֹҩƷ��Ⱦʵ��̨�Լ�ƿ��Ӧ���ţ�ʵ���в������������ǽ�������ܽ⣻����Լ�ƿ�����ţ���������ܽ⣻
��3������100g��������6%Ϊ���Ȼ�����Һ��Ӧ��ȡ�Ȼ��Ƶ�����Ϊ��100g��6%=6g����Ҫˮ�����Ϊ��100g-6g=94g��ˮ�����Ϊ��94g��1g/mL=94mL��Ӧѡ��100mL����Ͳ�����6��94��100mL��
��4����ƽ���������ԭ���ǣ���������=��������+���������������Ȼ��Ʒ�����ƽ�������У����������ƽ�������У������ڳ���������ʹ�������룬���ʹ��ȡ������С�������������ҩƷ��ʵ������Ϊ��5.0g-1.0g=4.0g������ȡˮ�����ʱ��С��ͬѧ���Ӷ����������ȡ��ˮ�٣�����������Һ���Ȼ��Ƶ���������ƫ���4.0��ƫ��

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
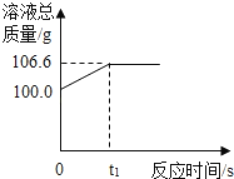
â���̸����������������ϵ�д�����Ŀ��ʵ������һƿ̼��ƺ��Ȼ��Ʒ�ĩ��ɵľ��Ȼ���С������ͬ��������������ϡ����û���ﷴӦ��������Һ��Ϊ��������Һ��������ʵ�����ݼ�¼���±�����������㣺
ʵ����� | һ | �� | �� | �� |
ϡ��������/g | 100.0 | 100.0 | 100.0 | 100.0 |
���������/g | 3.0 | 6.0 | 9.0 | 12.0 |
������Һ����/g | 101.9 | 103.8 | 105.0 | a |
ʣ���������/g | 0 | 0 | m | n |
��1����Ӧ��ϡ���ỹ��ʣ����ǵ�________�飻
��2����������̼��ƺ��Ȼ��Ƶ�����֮��________��
��3�������a��ֵΪ________��
��4�������m��ֵ____��
����Ŀ��������Ҫ��̼���⡢��Ԫ�أ����ܱ�������Ϩ���ԭ����ʲô��ȼ�յIJ�����ʲô��
��1��С����Ϊ����Ϩ���ԭ����ȼ���������������ڵ�����������ȼ�ղ���������룺
��ȼ�յIJ�������ж�����̼��
��ȼ�յIJ��������ˮ��
�����������룬��IJ��룺ȼ�յIJ��������________��
��2��ʵ��һ�����ܱ������е�ȼ������Ϩ�𣬳�ȡ10mL�ܱ������е����壬ע�뵽�Թ��еı��ͳ���ʯ��ˮ�У�����ʯ��ˮʼ��û�б���ǡ��ӿ�ѧ�Կ��ǣ���һ����_________��ѡ����ĸ����
A ֱ�ӵõ�ȼ�ղ�����û�ж�����̼�Ľ���
B �ٶ��ȡһЩ����ע�뵽�Թ��е�ʯ��ˮ��
C ���ӱ��ͳ���ʯ��ˮ������
��3��ʵ���������ʦ��ָ���£����ö�ܴ����������й����IJ�����װ����ͼ��ʾ��ʵ���������������к�ɫ���������ͬʱ�������ɵ�ʵ��ǰ����й����������ʾ��

���ʪ�� | �������� | ������̼���� | һ����̼���� | |
�����ȼǰ | 48.4% | 18.7% | 0.058% | 0 |
����Ϩ��� | 71.6% | 15.6% | 3.643% | 0.0182% |
��ʵ�鼰�������:
���ܱ�����������Ϩ���ԭ����________��
������ȼ�����ɵIJ�����________��