题目内容
【题目】酸、碱、盐在生产和生活中有着广泛的应用。
(1)下列有关说法正确的是_____。
A 脱水性属于浓盐酸的物理性质
B 碱中都含有金属离子和氢氧根离子
C 酸雨是pH小于7的雨水
D Na2CO3溶液能使无色酚酞溶液变红
(2)化学与我们的生活联系密切。焙制糕点所用的发酵粉的主要成分之一的盐是_____;治疗胃酸过多症可以用含氢氧化铝的药物,写出反应的化学方程式_____。
(3)小华同学做中和反应的实验时,将稀盐酸滴入到装有氢氧化钠固体的试管中,触摸试管壁有灼热感,于是他马上得出“氢氧化钠与稀盐酸反应会放出热量”的结论。但是小丽提出异议:热量不一定是氢氧化钠与稀盐酸反应放出的,理由是_____。
(4)NaCl溶液中有少量的CaCl2、MgSO4杂质,除去杂质的操作是:①依次加入过量的Ba(OH)2、Na2CO3溶液:②过滤:③向滤液中加适量的稀盐酸,然后蒸发、结晶。
①过滤时需要使用玻璃棒,则玻璃棒的作用是什么_____?
②请写出加入Ba(OH)2溶液的作用(用化学方程式表示)_____。
③过滤后滤液中除NaCl外,还含有什么成分_____?
(5)向10g部分变质的氢氧化钠样品中滴加73g的某盐酸恰好完全反应,结束后称量剩余液体的质量为80.8g,求原氢氧化钠样品中氢氧化钠的质量分数。_____
【答案】D 碳酸氢钠 Al(OH)3 +3HCl=AlCl3 +3H2O NaOH 固体溶于水也会放出热量 引流,防止液体溅出 Ba(OH)2 +MgSO4 =BaSO4↓+Mg(OH)2↓ NaOH 和 Na2CO3 47%
【解析】
(1)A 浓盐酸没有脱水性,此选项错误;
B 碱中一般含有金属离子和氢氧根离子,但氨水中不含有金属离子,此选项错误;
C 酸雨是pH小于5.6的雨水,此选项错误;
D Na2CO3溶液显碱性,能使无色酚酞溶液变红,此选项正确。故选D。
(2)焙制糕点所用的发酵粉的主要成分之一的盐是碳酸氢钠;治疗胃酸过多症可以用含氢氧化铝的药物,氢氧化铝能与胃液中的盐酸发生反应,反应的化学方程式是:Al(OH)3+3HCl=AlCl3+3H2O。
(3)小华同学做中和反应的实验时,将稀盐酸滴入到装有氢氧化钠固体的试管中,触摸试管壁有灼热感,于是他马上得出“氢氧化钠与稀盐酸反应会放出热量”的结论。但是小丽提出异议:热量不一定是氢氧化钠与稀盐酸反应放出的,理由是:NaOH 固体溶于水也会放出热量。
(4)NaCl溶液中有少量的CaCl2、MgSO4杂质,除去杂质的操作是:①依次加入过量的Ba(OH)2、Na2CO3溶液,氢氧化钡能与硫酸镁反应生成硫酸钡沉淀和氢氧化镁沉淀,碳酸钠能与氯化钙反应生成了碳酸钙沉淀和氯化钠,氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,通过过滤除去了硫酸钡沉淀、氢氧化镁沉淀、碳酸钙沉淀和碳酸钡沉淀,滤液中含有氯化钠、氢氧化钠和碳酸钠,向滤液中加适量的稀盐酸,碳酸钠、氢氧化钠与稀盐酸发生了反应,然后蒸发、结晶得到氯化钠。
①过滤时需要使用玻璃棒,则玻璃棒的作用是引流,防止液体溅出;
②由上述分析可知,加入Ba(OH)2溶液的作用是除去硫酸镁,方程式是:Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓。
③由上述分析可知,过滤后滤液中除生成的NaCl外,还含有NaOH和Na2CO3;
(5)根据质量守恒定律,生成二氧化碳的质量为:10g+73g﹣80.8g=2.2g
设碳酸钠的质量为x。
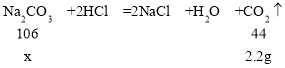
![]() 解得x=5.3g
解得x=5.3g
样品中氢氧化钠的质量分数:![]() ×100%=47%
×100%=47%