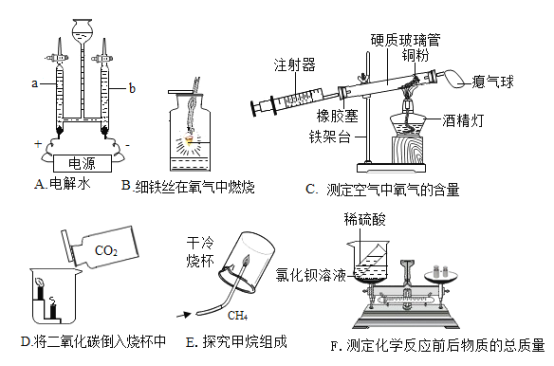
题目内容
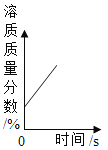
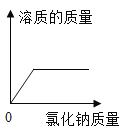
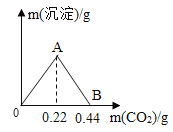
【题目】将2.60 g含有杂质的氢氧化钙样品平分为五等份。将其中一份全部溶于水配成稀溶液,再缓缓通入足量的CO2气体,先有白色沉淀X生成,后白色沉淀X逐渐消失。AB段反应的化学方程式为:X + CO2 + H2O=Ca(HCO3)2,生成沉淀的质量与通入CO2的质量关系如图所示(杂质可溶于水,但不参加反应)。
(1)氢氧化钙可由_____与水反应得到。
(2)计算样品中氢氧化钙的质量分数,写出必要的计算过程_____(计算结果保留到0.1%)。
【答案】氧化钙 71.2%
【解析】
(1)氧化钙与水反应可以生成氢氧化钙,故填写:氧化钙;
(2)由图可知,当消耗0.22g二氧化碳时,产生的沉淀X质量最大,此时,氢氧化钙与二氧化碳恰好完全发生了产生沉淀的反应,该反应是检验二氧化碳的反应,即氢氧化钙和二氧化碳反应生成水和碳酸钙,根据化学方程式简单计算可得:
解:设消耗0.22g二氧化碳时,消耗氢氧化钙的质量为x
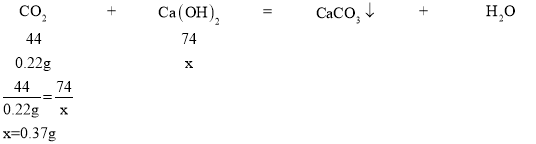
将2.60 g含有杂质的氢氧化钙样品平分为五等份,每一份的质量为:![]() =0.52g;
=0.52g;
样品中氢氧化钙的质量分数为:![]() ×100%≈71.2%
×100%≈71.2%
答:样品中氢氧化钙的质量分数为71.2%。

 口算题卡北京妇女儿童出版社系列答案
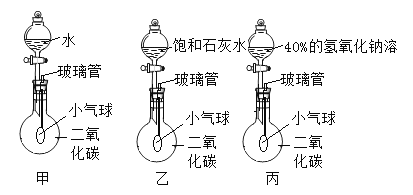
口算题卡北京妇女儿童出版社系列答案【题目】利用下表中的装置进行实验。有关该实验说法不正确的是( )
实验装置 | 实验步骤 |
| ①将a试管充满二氧化碳,b试管加入紫色石蕊溶液(K处于关闭状态) ②密闭下,用针筒将a试管中部分二氧化碳抽出 |
A. 用针筒将部分二氧化碳抽出,a试管中气体分子间间隔变大
B. 打开K,b试管中的液体颜色变红
C. 打开K,导管E内液面上升
D. 打开K,发生反应:H2O+CO2==H2CO3
【题目】某同学利用如图所示装置,选用不同可燃物测定空气里氧气的含量。实验起始时在集气瓶中装入少量水,并将水面上方空间分为五等份。将燃烧匙内的可燃物加热至燃烧或红热后,伸入瓶中塞紧瓶塞。冷却至室温后打开弹簧夹,记录数据如下表(装置的气密性良好)。
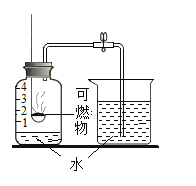
实验编号 | 可燃物 | 进入集气瓶中水的高度 |
① | 镁带 | 等于3格 |
② | 铁丝 | 几乎为0 |
③ | 红磷 | 约为0.6格 |
④ | 红磷 | 约为1.5格 |
下列有关解释不合理的是
A.实验①可能原因是:镁带除与氧气反应外,还能与空气中的其他气体反应
B.实验②可能原因是:铁丝燃烧消耗的氧气与生成的气体体积相等
C.实验③可能原因是:红磷量太少,集气瓶中的氧气未完全反应
D.实验④可能原因是:红磷点燃后,插入燃烧匙时,未迅速塞紧瓶塞,有部分空气逸出