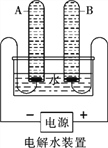
��Ŀ����
����Ŀ��ʵ������һ��̼���ƺ������ƵĻ�Ϸ�ĩ��Ϊ�ⶨ����̼���ƺ������Ƶ������ȣ�С��������ͼ��ʾ��ʵ�飺
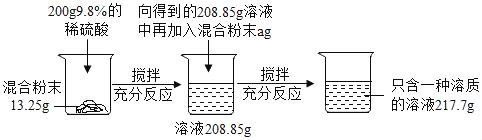
��ش��������⣺
��1������ʵ������з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��2����13.25g��Ʒ�м���20%ϡ������������������Ϊ_____��
��3��������֪�������г������13.25g��Ʒ��Ӧ��ϡ����������������x���ı���ʽ_____��
��4��a����ֵ��_____��
��5����Ϸ�ĩ��̼���ƺ������Ƶ�������Ϊ_____��
��6����Ҫʹ����������Һ���ʵ�����������Ϊ10%������Ҫ�����м���ˮ������Ϊ_____��
���𰸡�Na2CO3+H2SO4�TNa2SO4+H2O+CO2�� 4.4g ![]() 13.25 4��1 119.3g
13.25 4��1 119.3g
��������
̼���ƺ������ƵĻ�Ϸ�ĩ������ϡ����ֻ��̼���ƺ����ᷴӦ���������ơ�ˮ�Ͷ�����̼�����������غ㶨�ɿ������ɵĶ�����̼���������������ݶ�����̼����������Ӧ��ϡ���������ʵ�������̼���Ƶ������Լ����ɵ������Ƶ�������Ȼ��������ж�Ӧ�ļ��㡣
̼���ƺ������ƵĻ�Ϸ�ĩ������ϡ����ֻ��̼���ƺ����ᷴӦ���������ơ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪNa2CO3+H2SO4�TNa2SO4+H2O+CO2�������Na2CO3+H2SO4�TNa2SO4+H2O+CO2��
���������غ㶨�ɿ������ɵĶ�����̼������Ϊ13.25g+200g��208.85g��4.4g�����4.4g
�跴Ӧ��ϡ���������ʵ�������̼���Ƶ������Լ����ɵ������Ƶ������ֱ�Ϊx��y��z
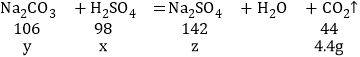
![]()
x��9.8g y��10.6g z��14.2g
���Ϸ�ĩ��̼���ƺ������Ƶ�������Ϊ10.6g����13.25g��10.6g����4��1
200gϡ�������������������Ϊ200g��9.8%��19.6g��������9.8g������9.8g�����Լ�������13.25g������ǡ����ȫ��Ӧ������a��13.25g�����![]() ��13.25
��13.25
Ҫʹ����������Һ���ʵ�����������Ϊ10%������Ҫ�����м���ˮ������
![]() ����13.25g+13.25g+200g��4.4g��4.4g����119.3g�����119.3g
����13.25g+13.25g+200g��4.4g��4.4g����119.3g�����119.3g

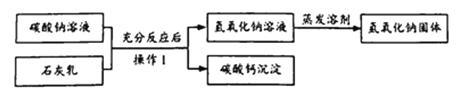
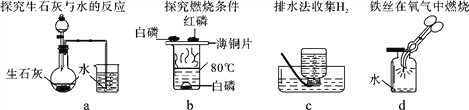
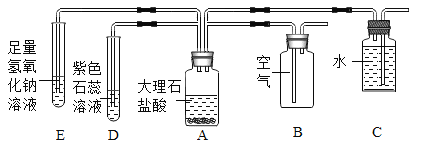
����Ŀ��ʵ���Ҳ���װ����ͼ��ʾ����ش��������⣮
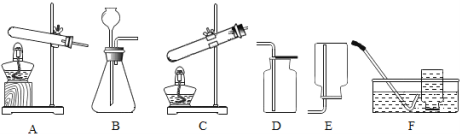
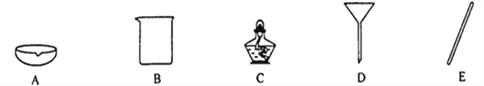
��1��ѡ�������ռ�������װ�û�ҩƷ����д���±��У�����ĸ����
ѡ��ҩƷ | ����װ�� | �ռ�װ�� |
_____ | B | _____ |
������� | _____ |
��2������ö���������Ũ�����Ʊ���������ѡ�õķ���װ����_____ ������ĸ����
��3��ѡ��Fװ���ռ�����ʱ������ʵ�������ȷ����_____ ������ţ���
�ٷ�Ӧǰ��������ƿע��ˮ���ò���Ƭ��סƿ�ڣ�������ʢˮ��ˮ����
�ڿ�ʼ��Ӧ�ȵ����������Ҿ���ʱ���ٽ����ܿ����뼯��ƿ
���ռ����������ƿ��ˮ�¸��ϲ���Ƭ���Ƴ�ˮ��
��ʵ�����ʱ���ȳ��߾ƾ��ƣ�Ȼ���ܴ�ˮ����ȡ��
��4����Bװ����ȡ����ʱ����Ӧ���ʱȽϿ죬���ܵ���ʵ���ò���ȫ���������õĸĽ���ʩ��_____��