题目内容
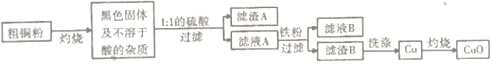
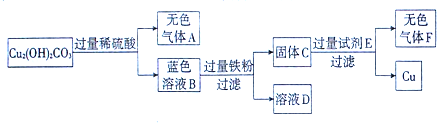
【题目】某化学小组的同学利用CuSO4、FeSO4的混合溶液进行如下探究实验。
(1)写出铝和硫酸铜溶液反应的化学方程式________________________。
(2)向固体A上滴加稀盐酸,若有气泡产生,则A中一定含有的固体有________________________。若无气泡产生,则溶液B中一定含有的溶质有________________________。
【答案】![]() 铁、铜 硫酸铝和硫酸亚铁
铁、铜 硫酸铝和硫酸亚铁
【解析】
铝和硫酸铜溶液反应生成铜和硫酸铝,铝和硫酸亚铁生成铁和硫酸铝,铝和稀盐酸反应生成氯化铝和氢气,铁和稀盐酸反应生成氯化亚铁和氢气。
(1)铝和硫酸铜溶液反应生成铜和硫酸铝,反应的化学方程式为![]() 。
。
(2) 铝的金属活动性比铁、铜强,铝会先和硫酸铜反应生成铜和硫酸铝,置换出溶液中的铜,然后铝和硫酸亚铁反应生成铁和硫酸铝,再置换出铁,铁的活动性排在氢之前,铁和稀盐酸反应生成氯化亚铁和氢气,铜不会与酸反应生成氢气,向固体A中滴加稀盐酸,有气泡产生,说明固体中一定含有铁、铜,可能含有铝;无气泡产生,说明固体中一定不含铁和铝,溶液中一定含有硫酸铝和硫酸亚铁。

 文敬图书课时先锋系列答案
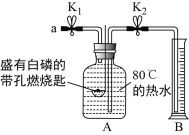
文敬图书课时先锋系列答案【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检查装置的气密性,气密性良好。 步骤Ⅱ.将盛有足量白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧 |
(1) 通过步骤________可知可燃物燃烧的条件之一是要有氧气。
(2) 将装置冷却一段时间后,打开K2,如果观察到________,说明空气中氧气的体积约占1/5。若该实验测得空气中氧气的体积分数小于1/5,原因可能 是________。