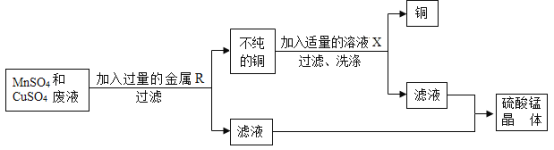
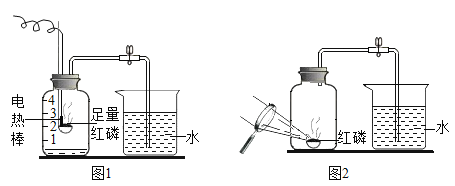
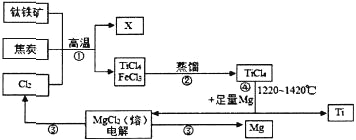
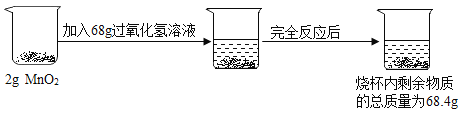
题目内容
【题目】下图是甲.乙.丙.丁四种常见金属与盐酸反应的比较示意图。以下说法错误的是( )
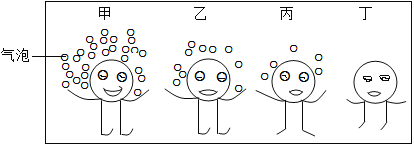
A. 如乙金属为Fe,则乙与盐酸反应的化学方程式为:2Fe+6HCl=2FeCl3+3H2↑
B. 金属甲.乙.丙与盐酸反应属于置换反应
C. 若乙是金属Al,则丙可能是Zn和Fe
D. 四种金属的活动性强弱顺序为:甲、乙、丙、丁
【答案】A
【解析】
A、铁和盐酸反应生成氯化亚铁和氢气,正确的化学方程式为:Fe+2HCl═FeCl2+H2↑,故A错误;
B、金属甲、乙、丙表面的气泡为三种金属与盐酸反应生成的氢气,这些反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,属于置换反应,故B正确;
C、金属乙表面气泡比金属丙多,说明金属乙与盐酸反应比金属丙剧烈,则金属乙的活动性比丙强;根据金属活动性:铝大于铁、锌,所以若乙为金属铝,丙可能为金属铁和锌,故C正确;
D、金属表面气泡多,反应越剧烈,活动性越强。图中金属甲表面气泡最多,其次为金属乙,最少的为金属丙,金属丁表面无气泡,所以四种金属活动性由强到弱的顺序为:甲>乙>丙>丁,故D正确。故选A。

练习册系列答案
相关题目