题目内容
【题目】小明为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验.请分析实验,完成填空。
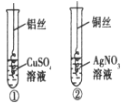
(1)试管①中观察到的现象是:铝丝表面附着一层________固体, 溶液颜色___________________;
(2)试管②中发生了化学反应,现象明显.该反应的化学方程式是___________________________;
(3)通过实验探究,Cu、Al、Ag三种金属活动性由强到弱的顺序是______________ _________。
【答案】(1)红色 ;由蓝色变为无色
(2) Cu+2AgNo3=Cu(NO3)2+2Ag[
(3)Al> Cu>Ag
【解析】
试题分析:(1)由2Al+3CuSO4═Al2(SO4)3+3Cu,铝丝浸入硫酸铜溶液中,铝丝表面附着一层固体,溶液颜色变浅,置换出铜;
(2)铜丝浸入硝酸银溶液中,由现象铜丝表面有银白色物质,可知铜在溶液中置换出银,
利用置换反应的特点,故化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag.
(3)通过实验探究,由2Al+3CuSO4═Al2(SO4)3+3Cu,Cu+2AgNO3=Cu(NO3)2+2Ag可知,金属的活泼性由强到弱的顺序是:Al>Cu>Ag.

【题目】黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
产生气体质量(g) | 0.3 | m | 0.9 | 1.0 | n |
按要求回答下列问题:
(1)根据实验数据分析,表中m的数值为 ,n的数值应该为 ;
(2)列式计算该黄铜样品中金属铜的质量分数。(要求写出计算过程)