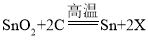题目内容
【题目】某化学兴趣小组的同学取氢氧化钠和碳酸钠的混合溶液50g装入烧杯中,每次滴加50g稀盐酸充分反应。测得部分数据及图像如下:
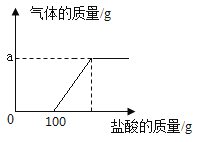
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸的质量/g | 50 | 50 | 50 | 50 | 50 |
烧杯中物质的质量/g | 100 | 150 | 197.8 | 245.6 | 295.6 |
请根据有关信息计算:
(1)a的数值为________。
(2)稀盐酸中溶质的质量分数为_____。(写出计算过程)
(3)恰好完全反应后所得溶液中溶质的质量为_____。(写出计算过程)
【答案】4.4 7.3% 23.4g
【解析】
根据质量守恒定律可知,反应前后质量的减少是因为生成了二氧化碳,可以先求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算所用盐酸溶液溶质的质量分数,再求出反应生成的溶质氯化钠的质量。
(1)由上分析可知a=50g+(5×50g)-295.6g=4.4g;(2)由题表可知第一次和第二次所加稀盐酸质量恰好和氢氧化钠完全反应,第三次所加稀盐酸和碳酸钠反应,生成二氧化碳质量为(3×50g)+50g-197.8g=2.2g,第四次所加盐酸和碳酸钠反应,生成二氧化碳质量为(4×50g)+50g-245.6g=2.2g,第五次加入稀盐酸的质量没有变化,即245.6g +50g=295.6g,说明第四次加入的稀盐酸恰好反应完毕,第五次加入的稀盐酸不参加反应,即和碳酸钠反应的稀盐酸的质量为50g+50g=100g,设和碳酸钠反应的100g稀盐酸中溶质质量为x,生成的氯化钠质量为y,

解得x=7.3g,y=11.7g,
稀盐酸中溶质质量分数为![]() =7.3%;
=7.3%;
(3)设氢氧化钠和稀盐酸反应生成的氯化钠质量为z,
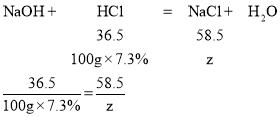
解得z=11.7g,
恰好完全反应后溶液中的溶质氯化钠质量为两部分,一部分是碳酸钠和稀盐酸反应生成的氯化钠(11.7g),一部分是氢氧化钠和稀盐酸反应生成的氯化钠(11.7g),即恰好完全反应后溶液中的溶质氯化钠质量为11.7g+11.7g=23.4g;
答:(1)a的数值为4.4g;(2)稀盐酸中溶质的质量分数为7.3%;(3)恰好完全反应后所得溶液中溶质的质量为23.4g。

【题目】某同学为探究铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
实验次数 项目 | 第一次 | 第二次 | 第三次 |
所取合金的质量/g | 20 | 20 | 40 |
所加稀硫酸的质量/g | 100 | 120 | 80 |
生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
根据该同学的实验,试回答以下问题:
(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是_____g.
(2)该铜铁合金中铁的质量分数是多少?_____。