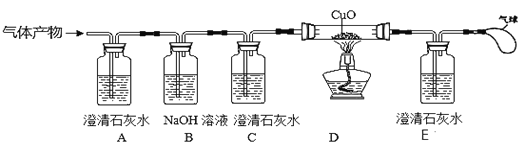
题目内容
【题目】属于分解反应的是
A. 2KMnO4![]() K2MnO4 + MnO2 + O2↑ B. CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2MnO4 + MnO2 + O2↑ B. CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
C. 2Na + Cl2![]() 2NaCl D. 2Mg + CO2
2NaCl D. 2Mg + CO2![]() 2MgO + C
2MgO + C
【答案】A
【解析】A、2KMnO4![]() K2MnO4 + MnO2 + O2↑,该反应符合“一变多”的特征,属于分解反应,正确;B、CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓,该反应中反应物有2种,不符合“一变多”的特征,不属于分解反应,错误;C、2Na + Cl2
K2MnO4 + MnO2 + O2↑,该反应符合“一变多”的特征,属于分解反应,正确;B、CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓,该反应中反应物有2种,不符合“一变多”的特征,不属于分解反应,错误;C、2Na + Cl2![]() 2NaCl,该反应中反应物有2种,不符合“一变多”的特征,不属于分解反应,错误;D、2Mg + CO2
2NaCl,该反应中反应物有2种,不符合“一变多”的特征,不属于分解反应,错误;D、2Mg + CO2![]() 2MgO + C,该反应中反应物有2种,不符合“一变多”的特征,不属于分解反应,错误。故选A。
2MgO + C,该反应中反应物有2种,不符合“一变多”的特征,不属于分解反应,错误。故选A。

 天天练口算系列答案
天天练口算系列答案【题目】某小组对石灰石进行煅烧,并对煅烧后固体成分进行探究。
(1)写出此反应的化学方程式_______________________。 (2)根据化学方程式进行猜想。固体残留物成分: I. 只有氧化钙;II. 只有碳酸钙;III. _____________ (3)甲乙丙三位同学分别设计了三种方案探究煅烧后固体成分。 友情提示:①CaO+2HCl→CaCl2+H2O; ②Ca(OH)2+2HCl→CaCl2+2H2O ③氯化钙溶液呈中性。 | |||||
方案设计 | 操作及现象 | 实验结论 | 解释 | ||
方案一 |
| 固体物质中 一定含有_______ | 用化学方程式解释判断理由_______。 | ||
方案二 |
| 乙同学得出 猜想II成立 | 该同学设计方案是否合理,理由是______。 | ||
方案三 |
| 猜想III成立 | |||
【题目】某化学兴趣小组设计了如下实验来探究影响锌与稀硫酸反应速率的因素(实验过程中杂质不能与稀硫酸反应),实验数据记录如下表:
实验编号 | 试剂 | 产生50mL氢气 的时间/s | ||
不同纯度的锌 | 稀硫酸的浓度 | 稀硫酸的用量/ mL | ||
a | 纯锌 | 30% | 30 | 52 |
b | 含杂质的锌 | 30% | 30 | 47 |
c | 纯锌 | 20% | 30 | 68 |
d | 纯锌 | 30% | 40 | 50 |
(1)实验_____和实验______(填实验编号)的实验目的是为了研究硫酸浓度对反应速率的影响。
(2)对比实验a和实验b,可以得到的实验结论是____________________。
(3)计算9.8g纯硫酸与足量的锌完全反应,可制得氢气是_________克?请你帮他们完善计算过程:
①______________②____________________