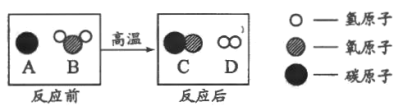
题目内容
【题目】某化学小组同学对碳酸氢钠、碳酸钠、氢氧化钠与酸的反应进行探究。
(实验1)向一定体积、一定浓度的氢氧化钠溶液中逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
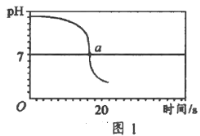
(1)实验1证明了氢氧化钠能与盐酸发生反应,其理由是_____.
(实验2)向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。
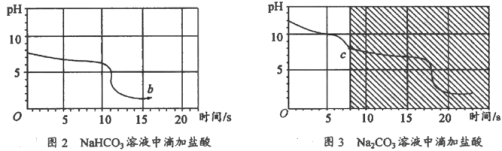
(2)实验2中,b点的溶质为_____,c点后发生反应的化学方程式为_____.
(3)依据实验2获取的信息,鉴别Na2CO3和NaHCO3溶液的实验方案为_____.
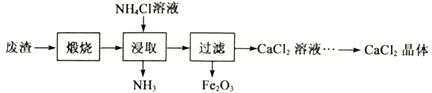
(实验3)实验小组对某纯碱样品的纯度进行测定:将一定质量的该样品(已知杂质只含NaCl)加水全部溶解后,得到52.2g溶液,向该溶液中逐渐加入50g稀盐酸恰好完全反应,产生的气体与加入稀盐酸的质量关系如图4所示,所得溶液的溶质质量分数为6%.
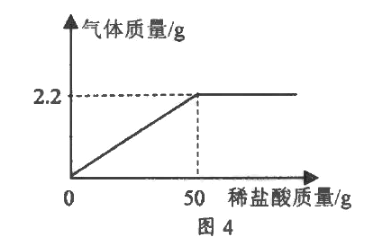
(4)求样品中Na2CO3的纯度_____。
【答案】实验过程中溶液的pH由大于7到小于7,说明氢氧化钠被消耗 NaCl、HCl ![]() 取两种溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠 97.2%
取两种溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠 97.2%
【解析】
(1)实验1证明了氢氧化钠能与盐酸发生反应,其理由是实验过程中溶液的pH由大于7到小于7,说明氢氧化钠被消耗;
(2)实验2中,b点的pH 小于7,b点的溶质有碳酸氢钠和盐酸反应生成的氯化钠和过量的盐酸中的氯化氢;c点后,碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:![]() ;
;
(3)依据实验3获取的信息可知,向碳酸钠溶液中滴加稀盐酸时,稀盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、水和二氧化碳,因此鉴别Na2CO3和NaHCO3固体的实验方案为:取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠;
(4)根据图示可知,加入50g稀盐酸时生成2.2g二氧化碳;
设:生成2.2g的二氧化碳需碳酸钠的质量为x,同时生成氯化钠的质量为y。
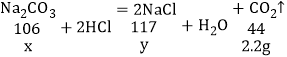
![]() x=5.3g;
x=5.3g;
![]() y=5. 85g;
y=5. 85g;
当恰好完全反应时,所得溶液的溶质质量分数为6%,因此溶质氯化钠质量=(52.2g+50g-2.2g)×6%=6g;原混合物中氯化钠的质量=6g-5.85g=0.15g;样品中Na2CO3的纯度=![]() 。
。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案