题目内容
【题目】Na2SO4是制作纸张、药品、染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如图1所示。
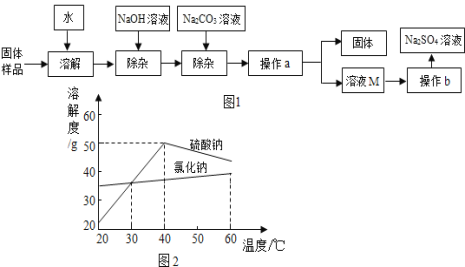
(1)加入NaOH溶液可除去的阳离子是____(填离子符号),其反应的化学方程式为: ____。若添加的NaOH和Na2CO3过量,可加入适量____(填名称)除去。
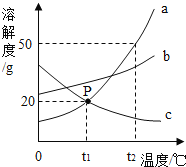
(2)溶液M中的溶质是Na2SO4和杂质NaCl,观察图2的溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤,降温结晶的最佳温度范围是__℃以下,因为Na2SO4的溶解度__。
【答案】Mg2+ 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 稀硫酸 30 在30℃以下比氯化钠小
【解析】
(1)由于加入的氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,因此除去的阳离子是Mg2+,反应的化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故NaOH和Na2CO3如果添加过量了,可在过滤后向滤液中滴加稀硫酸除去;
(2)由于硫酸钠的溶解度在30℃以下比氯化钠小,降温的过程中会析出大量的硫酸钠,故降温结晶的最佳温度范围是30℃以下。

【题目】在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜,拟选择两个方案。
方案 | 方案① | 方案② |
原理 | CuS是在硫杆菌(催化剂)的作用下与空气中的氧气发生化合反应生成硫酸铜 | 2CuS+3O2 CuO+H2SO4=CuSO4+H2O |
(1)请写出方案①反应的化学方程式_____。
(2)在两个方案中①更合理。理由是方案①具有以下优点:
优点一:_____优点二:_____。