题目内容
(8分)小丽来到实验室,看到实验桌上有一瓶敞口放置的氢氧化钠固体,于是对其是否变质产生了兴趣。她和同学们准备对这瓶固体进行探究。
【查阅资料】a.碳酸钠溶液显碱性,氯化钙溶液呈中性。
b.碳酸钠溶液与氯化钙溶液可以发生反应:Na2CO3 + CaCl2=CaCO3↓+2NaCl。
【作出猜想】猜想1.固体没有变质
猜想2.固体部分变质
猜想3.
【设计方案】
同学们经过讨论,认为两个方案都不合理。方案一不合理的原因是 ;
方案二不合理的原因是 。同学们重新设计了方案并进行了实验。
【实验探究】
若猜想3正确,该实验的现象应该是 。
【继续探究】同学们继续探究该氢氧化钠固体样品中碳酸钠的质量分数。利用以下装置进行了实验。

你认为她们需要测的数据是 (填字母序号)。
a.固体样品的质量 b.碱石灰实验前后的质量
c.浓硫酸实验前后的质量 d.氢氧化钠溶液实验前后的质量
e.所用稀硫酸的质量
【实验反思】根据所得数据进行计算发现结果比实际偏小,原因可能是 。
【查阅资料】a.碳酸钠溶液显碱性,氯化钙溶液呈中性。
b.碳酸钠溶液与氯化钙溶液可以发生反应:Na2CO3 + CaCl2=CaCO3↓+2NaCl。
【作出猜想】猜想1.固体没有变质
猜想2.固体部分变质
猜想3.
【设计方案】
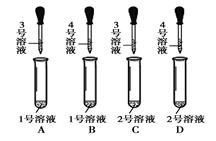
| | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取少量固体放入试管中,滴加几滴稀盐酸 | 无明显现象 | 猜想1正确 |
| 方案二 | 取少量固体放入试管中加水溶解,滴加足量澄清石灰水 | 产生白色沉淀 | 猜想2正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变为红色 |
方案二不合理的原因是 。同学们重新设计了方案并进行了实验。
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中加水溶解,滴加足量 | 产生白色沉淀 | 猜想2正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 | |
【继续探究】同学们继续探究该氢氧化钠固体样品中碳酸钠的质量分数。利用以下装置进行了实验。

你认为她们需要测的数据是 (填字母序号)。
a.固体样品的质量 b.碱石灰实验前后的质量
c.浓硫酸实验前后的质量 d.氢氧化钠溶液实验前后的质量
e.所用稀硫酸的质量
【实验反思】根据所得数据进行计算发现结果比实际偏小,原因可能是 。
【作出猜想】固体完全变质
【设计方案】
方案一:若样品变质,加入的少量稀盐酸先与NaOH反应,无明显现象;若样品完全变质,加入的几滴稀盐酸与Na2CO3反应,产生NaHCO3,也无明显现象
方案二:碳酸钠与石灰水反应产生的氢氧化钠也能使滤液中的酚酞变红
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| CaCl2溶液 | | |
| | 溶液由无色变为变红色 |
取少量固体放入试管中,滴加足量CaCl2后产生白色沉淀;取上层清液放入另一只试管中,滴加酚酞溶液后不变色
【继续探究】ad
【实验反思】A、B容器内还有剩余的CO2没有完全被氢氧化钠吸收
试题分析:1、【作出猜想】氢氧化钠敞口放置在空气中,会与空气中的二氧化碳反应,则氢氧化钠可能没有变质,可能部分变质;可能完全变质。故有猜想3.固体完全变质。
2、【设计方案】方案一:若样品变质,加入的少量稀盐酸先与NaOH反应,无明显现象;若样品完全变质,加入的几滴稀盐酸与Na2CO3反应,产生NaHCO3,也无明显现象
方案二:碳酸钠与石灰水反应产生的氢氧化钠也能使滤液中的酚酞变红
3、【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中加水溶解,滴加足量CaCl2溶液 | 产生白色沉淀 | 猜想2正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液由无色变为变红色 |
【继续探究】同学们继续探究该氢氧化钠固体样品中碳酸钠的质量分数。她们需要测的数据是a.固体样品的质量;d.氢氧化钠溶液实验前后的质量。根据反应生成的二氧化碳的质量,计算出原来物质碳酸钠的质量,进而计算氢氧化钠的质量和质量分数,这个过程中,要确保二氧化碳完全被氢氧化钠溶液吸收。
【实验反思】根据所得数据进行计算发现结果比实际偏小,原因可能是A、B容器内还有剩余的CO2没有完全被氢氧化钠吸收。
点评:实验探究过程中的实验猜想,要根据相关物质的性质和所处的条件来猜想,不是胡思乱想;实验探究的过程要严谨,否则就容易导致错误。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目

 (1)A实验在集气瓶中预先装入少量水的目的是 。
(1)A实验在集气瓶中预先装入少量水的目的是 。



 2CuO+CO2 + H2O
2CuO+CO2 + H2O 2Cu + CO2 ↑
2Cu + CO2 ↑