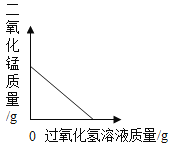
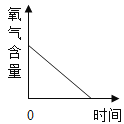
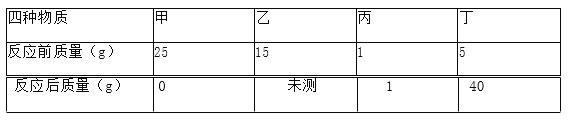
题目内容
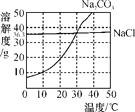
【题目】如图是a、b、c三种物质的溶解度曲线,请回答下列问题:
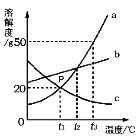
(1)三种物质的溶解度随着温度升高而减小的是_____。
(2)若a物质中混有少量的b物质,可用____方法提纯a。
(3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的溶液质量为____________g。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是________(填字母序号)。
A. a>b B.a=b C.a<b D.不能确定
【答案】c降温结晶/冷却结晶280A
【解析】
(1)根据图像可知,溶解度随着温度升高而减小的物质是c;
(2)a物质的溶解度随温度升高而明显增大,b物质的溶解度随温度变化不太明显,故可用降温结晶的方法提纯物质a;
(3)t3℃时,a物质的溶解度为50g,即100g水中能溶解a的最大质量为50g,故把80g物质a加入到200g水中充分搅拌、静置后,可得到a物质的不饱和溶液,溶液质量为280g;
(4)t3℃时,a物质的溶解度大于b物质的溶解度,故等质量a和b的饱和溶液中a溶质的质量大于b溶质的质量,又因t1℃时,a的溶解度小于b的溶解度,故降到t1℃时,析出晶体的质量a大于b,故本题选A。

 阅读快车系列答案
阅读快车系列答案【题目】碳酸钠是一种重要的化工原料。同学们在学习了它的化学性质后,对碳酸钠做如下的探究。
(演示实验)将酚酞滴加到碳酸钠溶液中。溶液变红色。
(查阅资料)
(1)Na2CO3在水中全部电离生成Na+和CO32-,CO32- + H2O ![]() HCO3-+ OH–
HCO3-+ OH–
(2)硫酸、盐酸、硝酸属于强酸,碳酸、醋酸属于弱酸。NaOH、KOH属于强碱,氨水属于弱碱。
(3)可溶性的盐溶液酸碱性由构成该盐对应的酸和碱的相对强弱决定。强酸与强碱反应生成的盐溶液显中性,强酸与弱碱反应生成的盐显酸性,强碱与弱酸反应生成的盐,显碱性。
(提出疑问)
在前面的学习中知道,碱遇酚酞变红色。碳酸钠属于_____类(填酸、碱、盐),其俗称是________,将酚酞滴加到碳酸钠溶液中,溶液变红色呈碱性。于是同学们提出自己的猜想:
(1)酚酞变红是溶液中钠离子作用的结果。
(2)酚酞变红是溶液中氢氧根离子作用的结果。
(实验探究)
实验操作 | 实验现象 | 结 论 |
将一定量的NaCl溶于水,滴入酚酞 | 溶液_______ | 猜想(1)已不成立 |
将一定量常见的一种常见的 碱______溶于水,滴入酚酞 | 溶液显红色 | 猜想(2)成立 |
(实验结论)Na2CO3溶液显碱性是因为Na2CO3在水溶液中生成了_____微粒的结果。
(讨论与交流)Na2CO3是强碱与弱酸反应生成的盐,溶液显碱性。由此推出,KNO3溶液显______性,NH4Cl溶液显_______性。通过学习CO32- + H2O ![]() HCO3-+ OH -,请写出铵根离子与水反应的化学方程式:________。
HCO3-+ OH -,请写出铵根离子与水反应的化学方程式:________。