题目内容
【题目】电解水可制氢气。通电一段时间后,如图所示。
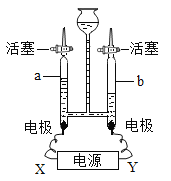
(1)电极X 为电源的_____极,若该反应消耗1mol 水,正极和负极产生气体的物质的量之比为_____。
(2)下图为电解水的微观示意图,请将右侧方框内的微粒补画完整_____。

(3)电解水过程中没有发生改变的微粒是_____(填微粒名称)。
(4)氢气作为新能源,其主要优点为_____(任写一个优点)。
【答案】正 1:2 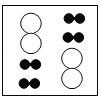 氢原子、氧原子 产物是水,没有污染等
氢原子、氧原子 产物是水,没有污染等
【解析】
(1)电解水实验原理:2H2O![]() 2H2↑+O2↑,正极产生氧气,负极产生氢气,氧气与氢气的体积比为1:2;电极X端产生的气体是氧气, 为电源的正极,若该反应消耗1mol 水,正极和负极产生气体的物质的量之比=分子个数比=化学方程式计量数之比=1:2。
2H2↑+O2↑,正极产生氧气,负极产生氢气,氧气与氢气的体积比为1:2;电极X端产生的气体是氧气, 为电源的正极,若该反应消耗1mol 水,正极和负极产生气体的物质的量之比=分子个数比=化学方程式计量数之比=1:2。
(2)下图为电解水的微观示意图,请将右侧方框内的微粒补画完整: 。
。
(3)原子是化学变化中的最小粒子,电解水过程中没有发生改变的微粒是氢原子、氧原子。
(4)氢气作为新能源,其主要优点为:产物是水,没有污染等。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
【题目】乙醇不完全燃烧时产生CO、CO2和H2O。依据下表数据分析得出的结论中,不正确的是:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. 表中的a值为1.4 B. 在化学反应前后碳元素质量一定相等
C. 参加反应的乙醇和氧气的质量比为3:4 D. 生成的CO和CO2分子个数比为1:3