题目内容
【题目】(7分)金属在生产生活中起着重要作用。
(1)铜可以做导线,主要利用了金属铜的延展性和 。
(2)赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(3)为了防止铁质水龙头生锈,其表面常镀一层铬,该措施防锈的原理是_____________。
(4)对Ag、Fe、Cu三种金属活动性顺序的探究,下列所选试剂组不可行的是 。
①Fe、Ag、CuSO4溶液 ②Cu、Ag、FeSO4溶液 ③Cu、FeSO4溶液、AgNO3溶液
(5)化学小组在实验结束后,进行了如下废液处理:
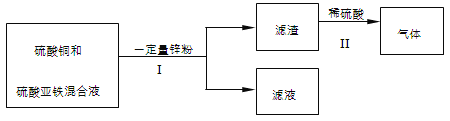
①Ⅰ中的操作名称是 。
②写出Ⅱ中一定发生反应的化学方程式 。
③滤液的组成可能是 。
【答案】(1)导电性 (2)Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
(3)隔绝氧气和水 (4)②
(5)①过滤 ②Fe + H2SO4 === Fe SO4 + H2↑
③硫酸锌或硫酸锌和硫酸亚铁
【解析】
试题分析:(1)性质决定用途,用途反映性质,铜可以做导线,主要利用了金属铜的延展性和导电性
(2) 赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为:Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
(3) 铁生锈的条件是与氧气和水接触,所以为了防止铁质水龙头生锈,其表面常镀一层铬,该措施防锈的原理是:隔绝氧气和水
(4) 探究三种金属的活动性,可利用的原理:1、金属与酸反应,根据是否反应或反应的激烈程度来判断活动性的强弱,2、金属与盐溶液反应,一般采用两种金属和一种盐溶液反应或一种金属和二种盐溶液反应,所以Ag、Fe、Cu三种金属活动性顺序的探究,②Cu、Ag、FeSO4溶液不可行,只能证明铁的活动性最强,Cu、Ag的活动性强弱比较不了,故选②
(5) ①进行操作Ⅰ后,是将固体和液体分离,是过滤
②实验Ⅱ加入稀硫酸产生气泡,说明滤渣中一定含有铁,所以Ⅱ中一定发生反应的化学方程式:Fe + H2SO4 === Fe SO4 + H2↑
③根据②可知,加入一定量的锌粉,一定发生了以下2个反应:CuSO4+Zn==ZnSO4+Cu和FeSO4+Zn==ZnSO4+Fe,由于生成了铁,说明第一个反应已经完全反应,第二个反应也一定发生,至于发生的程度就不确定,所以滤液的组成可能是硫酸锌或硫酸锌和硫酸亚铁

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案