��Ŀ����
����Ŀ�����ϸ�����ҵ�Ļ�����������ʾ��ͼ���£�
��ش��������⣺
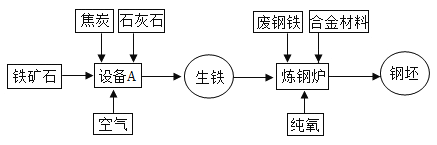
��1��д���豸A �����ƣ�_____________��
��2��д���Գ�����Ϊԭ���ڸ�������һ����̼��Ӧ��ȡ���Ļ�ѧ����ʽ��_______________ ��
��3��Ӧ�û�ѧԭ����������ҵ����ʱ�ô��������ÿ�����ԭ���ǣ�___________________��
��4����������ʯ�Ҷ��dz��õĸ��������������ѧ��������ijʳƷ���еĸ�������������е���һ�֣������������������_____________��
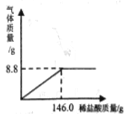
��5��������Ҫ����1200g������������Ϊ10%���������ⶨ���������ĺ�������Լ��������������Ϊ40%��Ũ���ᣨ�ܶ���1.2g/mL�ƣ�________������
���𰸡���¯ 3CO+Fe2O3![]() 2Fe+3CO2 ��ʹ��Ӧ���Ӿ��ң�����ø�������� ����ϡ���ᣬ�����ݲ�����Ϊ���ۣ�����Ϊ��ʯ�� 250
2Fe+3CO2 ��ʹ��Ӧ���Ӿ��ң�����ø�������� ����ϡ���ᣬ�����ݲ�����Ϊ���ۣ�����Ϊ��ʯ�� 250
��������
��1���豸A �����Ƹ�¯��
��2���Գ�����Ϊԭ���ڸ�������һ����̼��Ӧ��ȡ������һ����̼����������Ӧ�������Ͷ�����̼��
��3������Ũ��Խ��ӦԽ���ң�
��4����������ʯ�Ҷ��dz��õĸ����������ϡ���ᷴӦ���������������ƺ�ϡ����ᷴӦ����û�����ݲ�����
��5����Һ��ˮϡ�����У������������䡣
��1���豸A �����Ƹ�¯��
��2���Գ�����Ϊԭ���ڸ�������һ����̼��Ӧ��ȡ������һ����̼����������Ӧ�������Ͷ�����̼����ѧ����ʽΪ3CO+Fe2O3![]() 2Fe+3CO2��
2Fe+3CO2��
��3������Ũ��Խ��ӦԽ���ң�Ӧ�û�ѧԭ����������ҵ����ʱ�ô��������ÿ�����ԭ���Ǵ�ʹ��Ӧ���Ӿ��ң�����ø����������
��4����������ʯ�Ҷ��dz��õĸ����������ϡ���ᷴӦ���������������ƺ�ϡ����ᷴӦ����û�����ݲ�������������ѧ��������ijʳƷ���еĸ�����ķ�����������ϡ���ᣬ�����ݲ�����Ϊ���ۣ�����Ϊ��ʯ�ҡ�
��5����:����1200g������������Ϊ10����������������������Ϊ40����Ũ����x��
1200g��10����x��40����x=300g
Ũ��������Ϊ
300g��1.2g/mL=250mL��