题目内容
【题目】我国化学家侯德榜发明了联合制碱法,其生产纯碱和副产品氯化铵的工艺流程如图所示:
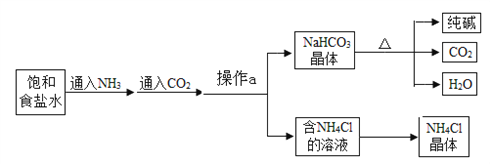
请回答下列问题:
(1)操作a的名称是 ;
(2)上述工艺流程中可循环利用的物质是 (填名称);
(3)氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,碳酸氢钠首先结晶析出,原因是 ;
(4)某制碱厂制出的Na2CO3中含有NaCl,取12g 该样品放入烧杯中,逐渐滴加溶质质量分数为10%的稀盐酸。烧杯中物质的总质量与所滴入稀盐酸的质量关系曲线如图所示,当恰好完全反应时,烧杯中为不饱和溶液,试通过计算求出此时溶液中所含溶质的质量。
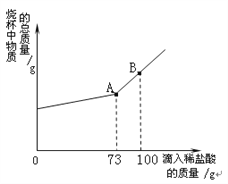
【答案】(1)过滤;(2)二氧化碳;(3)同温下碳酸氢钠的溶解度比氯化铵小,且反应时生成碳酸氢钠的质量比氯化铵大。(“同温下碳酸氢钠的溶解度比氯化铵小”,“反应时生成碳酸氢钠的质量比氯化铵大”二者答出一条就可得分);(4)13.1g
【解析】(1)操作a的名称是过滤;﹙2)上述工艺流程中可循环利用的物质是二氧化碳;(3)氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,碳酸氢钠首先结晶析出,原因是同温下碳酸氢钠的溶解度比氯化铵小,且反应时生成碳酸氢钠的质量比氯化铵大。(4)
解∶设Na2CO3 与稀盐酸反应生成氯化钠质量为xg,参与反应的碳酸钠质量为yg
2HCl+Na2CO3=2NaCl+H2O+CO2 ↑
73 106 117
73g×10% y x
![]() =
=![]() =
=![]() ,x=11.7g,y=10.6g.
,x=11.7g,y=10.6g.
此时溶液中所含溶质的质量是12g-10.6g+11.7g=13.1g。
答∶此时溶液中所含溶质的质量是13.1g。
点睛∶本题主要考查联合制碱法以及根据化学方程式进行计算。

练习册系列答案
相关题目