题目内容
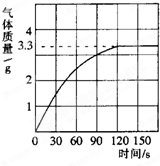 某校化学兴趣小组同学为了测定鸡蛋壳中碳酸钙的含量,将一定质量分数的稀盐酸逐滴加入到10.0g干燥的碎鸡蛋壳中,产生CO2气体的情况如图所示.当恰好完全反应时,消耗稀盐酸30.0g.求:
某校化学兴趣小组同学为了测定鸡蛋壳中碳酸钙的含量,将一定质量分数的稀盐酸逐滴加入到10.0g干燥的碎鸡蛋壳中,产生CO2气体的情况如图所示.当恰好完全反应时,消耗稀盐酸30.0g.求:(1)反应最多能产生CO2气体
3.3
3.3
g;(2)稀盐酸中溶质的质量分数为
18%
18%
;(3)鸡蛋壳中碳酸钙的质量分数(写出具体计算过程).
分析:(1)根据反应产生气体的情况图,当反应到120s时放出二氧化碳气体达最大值为3.3g;
(2)根据二氧化碳的质量结合所发生的化学方程式可以求算出盐酸中溶质的质量;
(3)放出二氧化碳达最大值时,鸡蛋壳中碳酸钙完全反应,根据反应的化学方程式,由放出二氧化碳的质量计算出碳酸钙质量,碳酸钙质量与鸡蛋壳的质量比可计算鸡蛋壳中碳酸钙的质量分数.
(2)根据二氧化碳的质量结合所发生的化学方程式可以求算出盐酸中溶质的质量;
(3)放出二氧化碳达最大值时,鸡蛋壳中碳酸钙完全反应,根据反应的化学方程式,由放出二氧化碳的质量计算出碳酸钙质量,碳酸钙质量与鸡蛋壳的质量比可计算鸡蛋壳中碳酸钙的质量分数.
解答:解:(1)由反应产生气体的情况图,可知10g水垢与盐酸反应后生成的二氧化碳最多是3.3g.
(2)设10.0g鸡蛋壳中碳酸钙的质量为x,稀盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 73 44
x y 3.3g
=
=
解得:x=7.5g,y=5.5g
(2)稀盐酸中溶质的质量分数为:
×100%=18%;
(3)鸡蛋壳中碳酸钙的质量分数=
х100%=75%;
答:(2)稀盐酸中溶质的质量分数为18%;
(3)鸡蛋壳中碳酸钙的质量分数是75%.
(2)设10.0g鸡蛋壳中碳酸钙的质量为x,稀盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 73 44
x y 3.3g
| 100 |
| x |
| 73 |
| y |
| 44 |
| 3.3g |
解得:x=7.5g,y=5.5g
(2)稀盐酸中溶质的质量分数为:
| 5.5g |
| 30.0g |
(3)鸡蛋壳中碳酸钙的质量分数=
| 7.5g |
| 10.0g |
答:(2)稀盐酸中溶质的质量分数为18%;
(3)鸡蛋壳中碳酸钙的质量分数是75%.
点评:本题利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2012?荔湾区一模)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
(2012?荔湾区一模)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.  某校化学兴趣小组同学在实验测定一块大理石中碳酸钙的质量分数.他们称取的大理石质量为12.5g,将其放入足量的稀盐酸中,产生气体的情况如图所示.计算该大理石中碳酸钙的质量分数?(大理石中除碳酸钙之外的其它杂质不与盐酸发生反应)
某校化学兴趣小组同学在实验测定一块大理石中碳酸钙的质量分数.他们称取的大理石质量为12.5g,将其放入足量的稀盐酸中,产生气体的情况如图所示.计算该大理石中碳酸钙的质量分数?(大理石中除碳酸钙之外的其它杂质不与盐酸发生反应) 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢后,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢后,产生CO2气体的情况如图所示.