题目内容
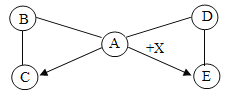
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A. 温度为![]() 时,100g甲、乙的饱和溶液,温度降到
时,100g甲、乙的饱和溶液,温度降到![]() 时,两溶液的质量仍然相等
时,两溶液的质量仍然相等
B. 温度为![]() 时,甲和乙各30g分别加入100g水中,均形成饱和溶液
时,甲和乙各30g分别加入100g水中,均形成饱和溶液
C. 温度为![]() 时,在100g水中加入50g乙,形成的是不饱和溶液
时,在100g水中加入50g乙,形成的是不饱和溶液
D. 甲的溶解度大于乙
【答案】B
【解析】
A、甲的溶解度受温度影响较大。温度为T1℃时,100g甲,乙的饱和溶液,温度降到T0℃时,甲析出的固体比乙多,两溶液的质量不相等,故A错误;
B、温度为T1℃时,它们的溶解度都小于30g,根据溶解度概念可知,甲和乙各30g分别加入100g水中,均形成饱和溶液,故B正确;
C、温度为T2℃时,乙的溶解度小于50g,根据溶解度概念可知,在100g水中加入50g乙,形成的是饱和溶液,故C错误;
D、没有指明温度,不能比较两种物质的溶解度,故D错误。故选B。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】在学习盐酸的化学性质时,甲、乙两位同学分别做了稀盐酸和碳酸钠溶液反应的实验(如图1)。
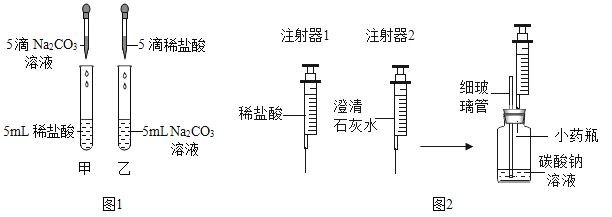
(实验现象)甲同学的实验中溶液有气泡冒出,乙同学的实验中溶液无气泡冒出。
(1)写出甲同学实验的化学反应方程式:_____________。
(提出问题)乙同学的实验中溶液为什么没有气泡冒出?
(查阅资料)碳酸钠和稀盐酸反应不仅可以生成二氧化碳还可以生成碳酸氢钠
(实验)同学们设计并进行了如图2所示的实验(装置气密性良好)。
实验编号 | 实验步骤 | 实验现象 |
① | Ⅰ.用注射器1向小药瓶中缓慢注入少量的稀盐酸,边注入边振荡 | 细玻璃管中液柱略微升高 |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水无明显变化 | |
② | Ⅰ.用注射器1向小药瓶中继续注入稀盐酸至较多气泡产生 | |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水变浑浊 |
(2)细玻璃管在实验中的主要作用是________;实验①中细玻璃管中液柱略微升高的原因___________。
(3)实验②中Ⅰ的现象是_________;实验①、②中步骤Ⅱ:注射器2必须缓慢地从瓶中抽取气体的原因是_________________。
(实验反思)此反应说明反应物的量不同,产物可能不同,试另举一例:____________。
(若正确回答下列问题加4分,总分不超过60分)
在老师的帮助下,同学们利用pH传感器对相同浓度的碳酸钠溶液(pH为12)、碳酸氢钠溶液(pH为8.2)与稀盐酸反应时,pH的变化与盐酸体积的关系进行了测定,并做了如下所示的对比图:
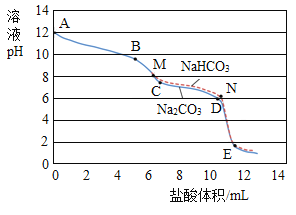
图中各线段实验现象如下表:
溶液 | 线段 | 实验现象 |
Na2CO3 | AB | 无气泡 |
BC | 有少量气泡 | |
CD | 有大量气泡 | |
DE | 几乎无气泡 | |
NaHCO3 | MN | 立即有大量气泡 |
NE | 几乎无气泡 |
(4)在AB段,溶液中的溶质有_________。
(5)分析图表,体现碳酸钠与稀盐酸反应分两步:
第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应的化学方程式为:__________。
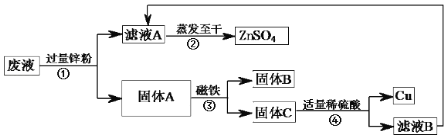
【题目】中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(![]() )的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式_____。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(![]() )晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
(查阅资料)
①![]() 易被空气中的氧气氧化
易被空气中的氧气氧化![]() 而变质。
而变质。
②![]() 在溶液中呈浅绿色,
在溶液中呈浅绿色,![]() 在溶液中呈黄色。
在溶液中呈黄色。
③![]() 的检验:向含
的检验:向含![]() 的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
(猜想与假设)猜想Ⅰ:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
(设计实验并验证)
实验操作步骤 | 实验现象 | 实验结论 |
取少量样品于试管中,加入2~3滴_____溶液 | 试管中溶液变成血红色 | ______ |
(实验拓展1)下列各组物质在溶液中能大量共存,且形成无色溶液的是_____。
A ![]() 、
、![]() 、
、![]() B
B ![]() 、
、![]() 、
、![]()
C ![]() 、
、![]() 、
、![]() D
D ![]() 、
、![]() 、
、
(实验拓展2)该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量的铁粉,写出其中的化学方程式_____。
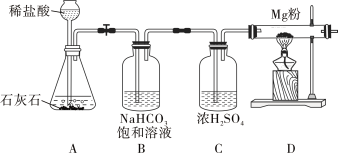
【题目】菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3yFe(OH)2zH2O]的组成,华雪同在老师的指导下设计了如图实验装置:
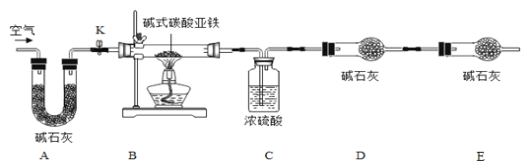
(查阅资料)
a.碱式碳酸亚铁受热会完全分解生成FeO、CO2以H2O。
b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。
c.碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
(实验步骤)
(1)检查装置的_____后,准备称取3.40g碱式碳酸亚铁粉末放在装置B中,连接仪器。
(2)_____,鼓入一段时间空气,准确称量装置C、D、E的质量。
(3)关闭弹簧夹K,加热装置B至装置C中导管末端无气泡冒出,再打开弹簧夹K,缓缓通空气一段时间,这样操作的目的是_____。
(4)再次准确称量装置C、D、E的质量,所得数据如下
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 200.36 | 180.88 | 180.00 |
(5)分析图、表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成H2O的质量为_____g,CO2的质量为_____g,装置E的作用是_____。
(实验结论)
在xFeCO3yFe(OH)2zH2O中,氢原子与氧原子的个数之比为_____。
(实验反思)
(1)装置A的作用是_____。
(2)实验结束后,装置B中的残留固体可能全部是FeO.也可能全部是Fe3O4.还可能是_____。
(3)为了得到装置B中残留固体的组成,华雪同学称得装置B中残留固体质量为2.24g后,通过计算可知:残留固体的组成及各成分的质量为_____。