题目内容
【题目】某学习小组收集一份铜锌合金样品,(设只含铜、锌),为认识其组成等,进行了以下实验:
实验序号 | ① | ② | ③ | ④ |
合金样品质量/g | 40 | 40 | 60 | 60 |
加入稀硫酸质量/g | 100 | 150 | 100 | 150 |
生成气体的质量/g | 0.2 | 0.2 | 0.2 | 0.3 |
(1)合金中铜、锌质量比为______
(2)稀硫酸质量分数是多少?(写出计算过程,结果精确到0.1%)
【答案】(1)33.5∶6.5或335∶65或67∶13(2)9.8%
【解析】
解:(1)由实验数据分析①、④金属和酸恰好完全反应,根据实验①或④的数据进行计算。
设:参加反应的硫酸的质量为x,锌的质量为y
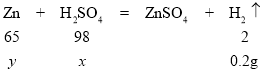
![]() y=6.5g
y=6.5g
![]() x=9.8g
x=9.8g
合金中铜和锌的质量比(40g-6.5g):6.5g=67:13;
(2)硫酸溶液的溶质质量分数:![]() 。
。

练习册系列答案
相关题目
【题目】化学是以实验为基础的学科,根据下列实验回答问题。
实验一 | 实验二 |
|
|
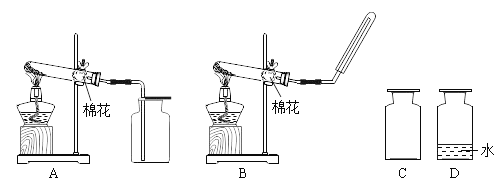
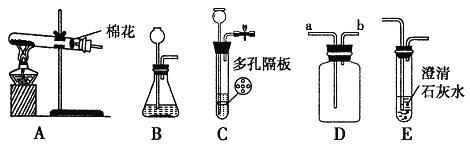
(1)实验一:
①实验室用高锰酸钾制取氧气应选用的装置是________,(填字母),发生反应的化学方程式为________。
②装置C、D是收集到的两瓶氧气,若进行铁丝在氧气中燃烧的实验,应选用的一瓶是________(填字母);实验中可观察到铁丝剧烈燃烧,________。
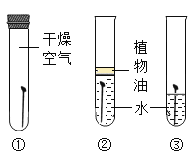
(2)实验二:三天后,观察到序号为________的试管中铁钉明显生锈。对照实验①和③,可知铁锈蚀与______有关。