题目内容
如图所示实验,A为一种无色、无刺激性气味的气体,装置Ⅰ硬质玻璃管中装有1.60克红色粉末B,A、B均属纯净物.有关实验内容如下:
| 实验内容 | 现象 | 测定结果 |
| ①使A持续地通过实验装置Ⅰ、Ⅱ、Ⅲ | Ⅰ中红色粉末逐渐全部变黑 | Ⅰ中产生的黑色粉末的质量为1.12克 |
| ②当A和B在加热下反应时 | Ⅱ中干燥管里的无水CuSO4无变化 | |
| ③实验完毕时,先移去并熄灭酒精灯,冷至室温后,再停止通A | Ⅲ中澄清石灰水变浑浊 | Ⅲ中沉淀1.00克 |
原子质量是______.
(2)硬质玻璃管中发生反应的化学方程式是______ 2Fe+3CO2
【答案】分析:(1)由题意可知,1.60克红色粉末B(Fe2O3),黑色粉末(铁)1.16克,它与足量稀硫酸反应生成一种盐RSO4,则R的相对原子质量是56.
(2)题中硫酸铜无变化,说明反应无水生成,起还原作用的是一氧化碳,而不是氢气.所以可以书写化学方程式.
(3)由题意可知,1.60克红色粉末B(Fe2O3),黑色粉末(铁)1.16克,计算可知,生成的二氧化碳的质量为1.12克.如果和足量的澄清石灰水反应将生成三克碳酸钙,而题中只生成碳酸钙1克.所以,二氧化碳又和水、碳酸钙生成碳酸氢钙.
(4)尾气含有一氧化碳,将会污染空气,所以燃烧.
解答:解:(1)由分析可知,红色粉末B为Fe2O3,黑色粉末为铁,因此R的相对原子质量是56.
(2)由分析可知,起还原作用的是一氧化碳,所以:Fe2O3+3CO 2Fe+3CO2,计算可知,生成的二氧化碳的质量为1.12克.
2Fe+3CO2,计算可知,生成的二氧化碳的质量为1.12克.
(3)①、Ca(OH)2+CO2=CaCO3↓+H2O,计算可知,消耗二氧化碳0.88克,生成碳酸钙2克.
②、CaCO3+CO2+H2O=Ca(HCO3)2,计算可知,消耗二氧化碳0.44克,用掉碳酸钙1克生成碳酸氢钙,所以题中只生成1.00克碳酸钙.因此装置Ⅲ内的液体除沉淀物外,还有的物质是 碳酸氢钙.
(4)尾气含有一氧化碳,将会污染空气,所以燃烧.,防止其污染空气.
故答为:(1)56
(2)Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
(3)碳酸氢钙
(4)除去尾气中的CO,防止其污染空气.
点评:掌握根据化学方程式计算的步骤和方法;正确找出题中的突破口,分析完毕,一定要验证是否正确.
(2)题中硫酸铜无变化,说明反应无水生成,起还原作用的是一氧化碳,而不是氢气.所以可以书写化学方程式.
(3)由题意可知,1.60克红色粉末B(Fe2O3),黑色粉末(铁)1.16克,计算可知,生成的二氧化碳的质量为1.12克.如果和足量的澄清石灰水反应将生成三克碳酸钙,而题中只生成碳酸钙1克.所以,二氧化碳又和水、碳酸钙生成碳酸氢钙.
(4)尾气含有一氧化碳,将会污染空气,所以燃烧.
解答:解:(1)由分析可知,红色粉末B为Fe2O3,黑色粉末为铁,因此R的相对原子质量是56.
(2)由分析可知,起还原作用的是一氧化碳,所以:Fe2O3+3CO
 2Fe+3CO2,计算可知,生成的二氧化碳的质量为1.12克.
2Fe+3CO2,计算可知,生成的二氧化碳的质量为1.12克.(3)①、Ca(OH)2+CO2=CaCO3↓+H2O,计算可知,消耗二氧化碳0.88克,生成碳酸钙2克.
②、CaCO3+CO2+H2O=Ca(HCO3)2,计算可知,消耗二氧化碳0.44克,用掉碳酸钙1克生成碳酸氢钙,所以题中只生成1.00克碳酸钙.因此装置Ⅲ内的液体除沉淀物外,还有的物质是 碳酸氢钙.
(4)尾气含有一氧化碳,将会污染空气,所以燃烧.,防止其污染空气.
故答为:(1)56
(2)Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2(3)碳酸氢钙
(4)除去尾气中的CO,防止其污染空气.
点评:掌握根据化学方程式计算的步骤和方法;正确找出题中的突破口,分析完毕,一定要验证是否正确.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
如图所示实验,A为一种无色、无刺激性气味的气体,装置Ⅰ硬质玻璃管中装有1.60克红色粉末B,A、B均属纯净物.有关实验内容如下:
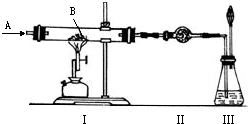
(1)若将所得黑色粉末加入足量稀硫酸中,可生成H20.04克,同时生成一种盐RSO4,则R的相对
原子质量是 .
(2)硬质玻璃管中发生反应的化学方程式是 .
(3)反应后,装置Ⅲ内的液体除沉淀物外,还有的物质是 .
(4)装置Ⅲ处由尖咀管排出的气体,要点火引燃的原因是 .

| 实验内容 | 现象 | 测定结果 |
| ①使A持续地通过实验装置Ⅰ、Ⅱ、Ⅲ | Ⅰ中红色粉末逐渐全部变黑 | Ⅰ中产生的黑色粉末的质量为1.12克 |
| ②当A和B在加热下反应时 | Ⅱ中干燥管里的无水CuSO4无变化 | |
| ③实验完毕时,先移去并熄灭酒精灯,冷至室温后,再停止通A | Ⅲ中澄清石灰水变浑浊 | Ⅲ中沉淀1.00克 |
原子质量是
(2)硬质玻璃管中发生反应的化学方程式是
(3)反应后,装置Ⅲ内的液体除沉淀物外,还有的物质是
(4)装置Ⅲ处由尖咀管排出的气体,要点火引燃的原因是
如图所示实验,A为一种无色、无刺激性气味的气体,装置Ⅰ硬质玻璃管中装有1.60克红色粉末B,A、B均属纯净物.有关实验内容如下:

(1)若将所得黑色粉末加入足量稀硫酸中,可生成H20.04克,同时生成一种盐RSO4,则R的相对
原子质量是______.
(2)硬质玻璃管中发生反应的化学方程式是______ 2Fe+3CO2

| 实验内容 | 现象 | 测定结果 |
| ①使A持续地通过实验装置Ⅰ、Ⅱ、Ⅲ | Ⅰ中红色粉末逐渐全部变黑 | Ⅰ中产生的黑色粉末的质量为1.12克 |
| ②当A和B在加热下反应时 | Ⅱ中干燥管里的无水CuSO4无变化 | |
| ③实验完毕时,先移去并熄灭酒精灯,冷至室温后,再停止通A | Ⅲ中澄清石灰水变浑浊 | Ⅲ中沉淀1.00克 |
原子质量是______.
(2)硬质玻璃管中发生反应的化学方程式是______ 2Fe+3CO2


