题目内容
【题目】有一工业过程: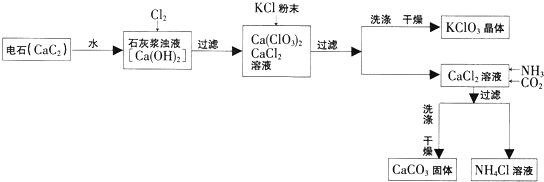
按要求回答下列问题:
(1)请将电石与水反应的化学方程式补充完整:CaC2+2H2O═Ca(OH)2+↑.
(2)有关物质常温下的溶解度如表:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入了KCl粉末,KCl与(填化学式)发生了复分解反应得KClO3晶体,该过程得到KClO3晶体的原因是 .
(3)写出向CaCl2溶液中通入两种气体生成CaCO3的化学方程式: .
【答案】
(1)C2H2
(2)Ca(ClO3)2;在常温下氯酸钾的溶解度较小,生成的氯酸钾过量会结晶析出
(3)H2O+2NH3+CO2+CaCl2=CaCO3↓+2NH4Cl
【解析】解:(1)根据质量守恒定律,化学反应前后原子的种数和数目不变判断另一种生成物是水,故填:C2H2;(2)由图中反应流程氯化钾加入到氯化钙和氯酸钙混合物中发生反应,根据复分解反应发生的条件,氯化钙与氯化钾不反应,故氯化钾只能与氯酸钙反应生成氯酸钾;由题中物质在常温下的溶解度表中数据发现氯酸钾的溶解度较小,故生成氯酸钾由于常温下氯酸钾溶解度较小,所以过量的氯酸钾会结晶析出;故填:Ca(ClO3)2;在常温下氯酸钾的溶解度较小,生成的氯酸钾过量会结晶析出;(3)由题中信息判断反应物是NH3、CO2和CaCl2溶液,生成物是CaCO3固体和NH4Cl溶液,反应的化学方程式为:H2O+2NH3+CO2+CaCl2=CaCO3↓+2NH4Cl.
(1)根据已有物质和质量守恒定律补全化学方程式;(2)根据图中反应流程,判断找出能与氯化钾反应生成氯酸钾的物质;根据图中所给信息中氯酸钾的溶解度进行分析解答;(3)根据题中所给反应物和生成物书写化学方程式.此题综合考查物质的相互转化和制备,掌握质量守恒定律和正确书写化学方程式的方法是解题的关键.

 口算题天天练系列答案
口算题天天练系列答案