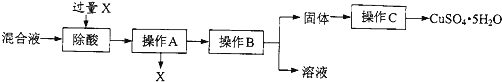
��Ŀ����
����Ŀ��������þ������һ������ϡHCl�У������������ݺ���ֻҰ�ɫ���壮ijͬѧ�Ը�����������̽����
��1����һ���������ݷ�Ӧ�Ļ�ѧ����ʽ ��
��2�����������ˡ�ϴ�ӡ�һ���¶��º�ɵûҰ�ɫ���壮�ԻҰ�ɫ���������²²Ⲣ����ʵ�飺
[�²�]�Ұ�ɫ��������ǣ���ʣ���Mg����MgCl2���壻��Mg��MgCl2���壮
[ʵ��]��ȡ�Ұ�ɫ������Ʒ������ϡHCl�������ݲ�������²���ѡ����ţ���������
�ڳ�ȡ�������ĻҰ�ɫ�����MgCl2����ֱ����ͬ�¡�����ˮ�У��Ұ�ɫ���岻�ܽ��MgCl2����ȫ�� �� ��²�ڲ�������
�������ϣ�Mg��MgCl2������Һ��Ӧ�����ɻҰ�ɫ��ʽ�Ȼ�þ[Mgx��OH��yClz]���䲻����ˮ�������ᷴӦ��
��ȡһ�����ĻҰ�ɫ���壬����ϡ���ᣬ��������Һ�ֳ����ȷݣ�
a.��һ����Һ�еμӹ�����NaOH��Һ��������1.160gMg��OH��2������
b.����һ����Һ�еμӹ�����AgNO3��Һ��������1.435g������
��3��֤��AgNO3��Һ�����ķ��������ã����ϲ���Һ�еμ���Һ��������
��4��[����]x��z= �� ���ü�ʽ�Ȼ�þ�Ļ�ѧʽΪ ��
���𰸡�
��1��Mg+2HCl=MgCl2+H2��
��2���٢ۣ��ܽ�
��3��������
��4��2��1��Mg2��OH��3Cl
����������һ��þ��ϡ���ᷴӦ�����Ȼ�þ�����������Mg+2HCl=MgCl2+H2������������ʵ�顿��ȡ�Ұ�ɫ������Ʒ������ϡHCl�������ݲ�����֤���ð�ɫ������û�н���þ�����Բ���٢۴�����٢ۣ��ڳ�ȡ�������ĻҰ�ɫ�����MgCl2����ֱ����ͬ�¡�����ˮ�У��Ұ�ɫ���岻�ܽ��MgCl2����ȫ���ܽ⣬��²�ڲ�����������ܽ⣻��֤��AgNO3��Һ�����ķ��������ã����ϲ���Һ�еμ���������Һ�ȣ�������֤�����������������ǹ����ģ������������
�����ۡ��躬þԪ�ص�����Ϊw
Mgx��OH��yClz����xMg����xMg��OH��2
��������������������24x ����58x
��������������������w ����1.160g![]()
w=0.48g��
�躬��Ԫ�ص�����Ϊm
Mgx��OH��yClz����zCl����zAgCl
������������������35.5z �� 143.5z
������������������m ����1.435g![]()
m=0.355g��
x��z= ![]() ��
�� ![]() =2��1
=2��1
����Mg2��OH��yCl���ڻ������У�þԪ����+2�ۣ��������ԩ�1�ۣ���Ԫ���ԩ�1�ۣ����ݻ������и�Ԫ�ص��������ϼ۵Ĵ�����Ϊ���֪����+2����2+����1��y+����1��=0��y=3�����2��1��Mg2��OH��3Cl��
�����㾫�������ս������ϵ�ѡ�����ݺ���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�ǽ����ĸ�������Ҫ֪����ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ�������������������ע�⣺a����ƽ b������ c�����ţ�

����Ŀ����һ��ҵ���̣�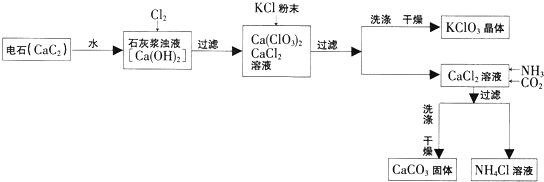
��Ҫ��ش��������⣺
��1���뽫��ʯ��ˮ��Ӧ�Ļ�ѧ����ʽ����������CaC2+2H2O�TCa��OH��2+����
��2���й����ʳ����µ��ܽ�������
���� | Ca��ClO3��2 | CaCl2 | KClO3 | KCl |
�ܽ��/g | 209.0 | 74.5 | 7.3 | 34.2 |
���������м�����KCl��ĩ��KCl�����ѧʽ�������˸��ֽⷴӦ��KClO3���壬�ù��̵õ�KClO3�����ԭ���� ��
��3��д����CaCl2��Һ��ͨ��������������CaCO3�Ļ�ѧ����ʽ�� ��