题目内容
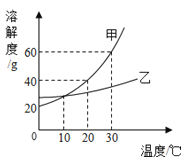
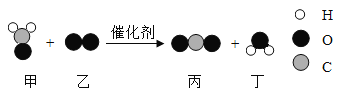
【题目】氧化镁和氧化铜混合物m g,加100 g质量分数为10.95%的稀盐酸,混合物恰好完全溶解。若将mg该混合物在过量CO气流中加热充分反应,冷却后剩余固体质量为
A.(m﹣1.6)gB.(m﹣2.4)gC.(m﹣3.2)gD.无法确定
【答案】B
【解析】
本题要利用在化学反应中元素种类和质量不变,进行计算。
金属氧化物与酸反应生成盐和水,因此水中氢元素的质量等于酸中氢元素的质量,水中氧元素的质量等于金属氧化物中氧元素的质量。氧化镁和氧化铜混合物m g,加100 g质量分数为10.95%的稀盐酸,混合物恰好完全溶解。100 g稀盐酸中氯化氢的质量为![]() ,10.95 g氯化氢中含氢元素的质量为
,10.95 g氯化氢中含氢元素的质量为![]() ,已知水中氢元素和氧元素的质量比为1:8,含0.3g氢元素的水中氧元素的质量为
,已知水中氢元素和氧元素的质量比为1:8,含0.3g氢元素的水中氧元素的质量为![]() 。所以m g氧化镁和氧化铜混合物中含氧元素的质量为2.4g,将mg该混合物在过量CO气流中加热充分反应,冷却后剩余固体质量为混合物中含铜元素和镁元素的质量,因此剩余固体质量为
。所以m g氧化镁和氧化铜混合物中含氧元素的质量为2.4g,将mg该混合物在过量CO气流中加热充分反应,冷却后剩余固体质量为混合物中含铜元素和镁元素的质量,因此剩余固体质量为![]() 。故选B。
。故选B。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
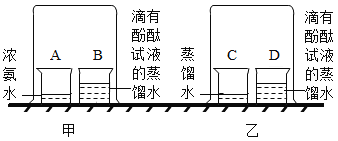
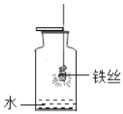
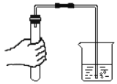
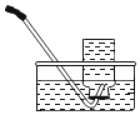
暑假接力赛新疆青少年出版社系列答案【题目】下列实验中对水的作用解释不正确的是( )
A | B | C | D | |
实验 内容 |
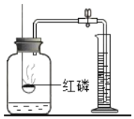
空气中O2量测定 |
铁丝在氧气中燃烧 |
检查气密性 |
收集氧气 |
水的作用 | 通过量筒中水体积变化得出O2体积。 | 防止熔融物溅落下来炸裂集气瓶。 | 降温,便于气 密性检查。 | 排净空气,便于观察何时集满。 |
A. AB. BC. CD. D
【题目】将3份质量为8g的硫分别在一定量氧气中燃烧,记录数据如下表所示。
实验次数 | 第一次 | 第二次 | 第三次 |
氧气的质量 /g | 2 | 6 | 10 |
二氧化硫的质量 /g | 4 | 12 | 16 |
(1)该反应的化学反应方程式__________________;
(2)参加反应的硫、氧气和生成的二氧化硫之间的质量比为__________________;
(3)在第________次实验中,硫有剩余,剩余__________________ ;
(4)在第________次实验中,氧气有剩余,剩余__________________ g。