题目内容
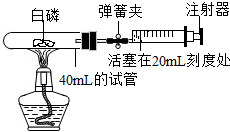 (1)为测定空气中氧气的含量,某兴趣小组的同学选用了40mL的试管作反应容器(如图)和量程体积足够大且润滑效果很好的针筒注射器,将足量的白磷放入试管后,用橡皮塞塞紧试管,并夹紧弹簧夹.用酒精灯加热白磷,燃烧结束后,等到试管冷却后松开弹簧夹,观察现象.
(1)为测定空气中氧气的含量,某兴趣小组的同学选用了40mL的试管作反应容器(如图)和量程体积足够大且润滑效果很好的针筒注射器,将足量的白磷放入试管后,用橡皮塞塞紧试管,并夹紧弹簧夹.用酒精灯加热白磷,燃烧结束后,等到试管冷却后松开弹簧夹,观察现象.①正式开始实验前,该兴趣小组同学打开弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处.该操作的主要目的是
②实验后,可以观察到针筒活塞会从原来的20mL刻度处慢慢向左移到约
A.4mL刻度,B.8mL刻度,C. 12mL刻度,D. 16mL刻度
③下列实验操作,对实验结果有影响的是
A.装置有点漏气,B.白磷的量不足,C.用干燥的红磷代替白磷做实验
(2)小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 |
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的
[实验探究]小婧设计实验证实了自己猜想,她的实验方案是
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:
分析:本题是用白磷燃烧消耗氧气来验证空气中氧气的体积分数,要使实验结果准确可靠,需保证装置气密性良好,如果药品换成镁来验证,将会出现不同的结果.原因是镁不但能和氧气反应,还能和空气中的氮气反应.
解答:解:(1)①该过程是检验装置的气密性,如果装置漏气,活塞就不能回到原来的位置.故填:检查装置的气密性;
②实验后,白磷燃烧消耗了试管中大约五分之一的氧气,空气的体积为40mL,含有氧气8mL,活塞向左移至约12mL刻度处.故填:C;
③装置漏气或白磷不足,测量结果偏低.故选A、B;
(2)根据质量守恒定律,反应前后,元素的种类保持不变,因为空气中没有含氯元素的物质,所以产物中不可能有氯化镁.故填:根据质量守恒定律,反应前后,元素的种类保持不变,空气中没有含氯元素的物质;
[提出猜想]根据资料,氮化镁的颜色为淡黄色,所以有可能是氮气造成的.故填:氮气;
[实验探究]为了证明猜想,可将燃烧的镁带放入盛有氮气的集气瓶中,观察镁带能否继续燃烧,如果能燃烧,观察产物是什么颜色.故填:将燃烧的镁带放入盛有氮气的集气瓶中,观察现象.
[实验结论]镁能与氧气反应生成氧化镁,能与氮气反应生成氮化镁,故填:2Mg+O2
2MgO,3Mg+N2
Mg3N2.
②实验后,白磷燃烧消耗了试管中大约五分之一的氧气,空气的体积为40mL,含有氧气8mL,活塞向左移至约12mL刻度处.故填:C;
③装置漏气或白磷不足,测量结果偏低.故选A、B;
(2)根据质量守恒定律,反应前后,元素的种类保持不变,因为空气中没有含氯元素的物质,所以产物中不可能有氯化镁.故填:根据质量守恒定律,反应前后,元素的种类保持不变,空气中没有含氯元素的物质;
[提出猜想]根据资料,氮化镁的颜色为淡黄色,所以有可能是氮气造成的.故填:氮气;
[实验探究]为了证明猜想,可将燃烧的镁带放入盛有氮气的集气瓶中,观察镁带能否继续燃烧,如果能燃烧,观察产物是什么颜色.故填:将燃烧的镁带放入盛有氮气的集气瓶中,观察现象.
[实验结论]镁能与氧气反应生成氧化镁,能与氮气反应生成氮化镁,故填:2Mg+O2
| ||
| ||
点评:本题主要能分析实验探究过程,并且能正确写出化学方程式,可以依据题干提供的信息结合已有的知识进行,书写反应的化学方程式要注意配平.

练习册系列答案
相关题目

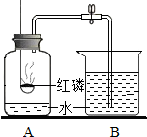 (2012?哈尔滨模拟)如图为某同学设计的测定空气中氧气含量的实验:
(2012?哈尔滨模拟)如图为某同学设计的测定空气中氧气含量的实验:
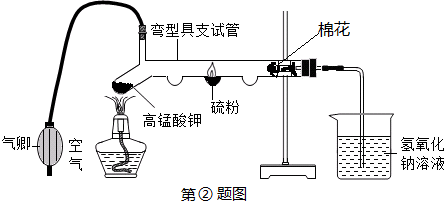
 )、悬浮颗粒物、氮氧化合物是主要的大气污染物.某校化学课外活动小组为测定校园附近空气中二氧化硫(
)、悬浮颗粒物、氮氧化合物是主要的大气污染物.某校化学课外活动小组为测定校园附近空气中二氧化硫( )、悬浮颗粒物的含量,根据反应原理,设计如图所示装置.
)、悬浮颗粒物的含量,根据反应原理,设计如图所示装置.





