题目内容
【题目】请结合下列实验常用装置,回答有关问题。
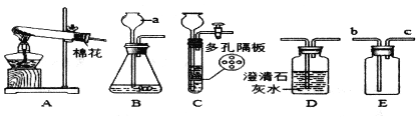
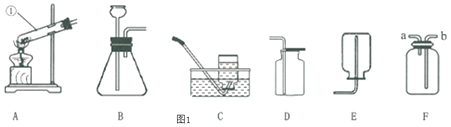
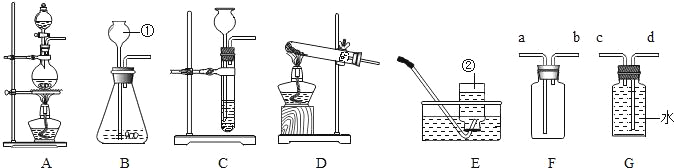
![]() 写出图中标有字母的仪器a名称______。
写出图中标有字母的仪器a名称______。
![]() 若用高锰酸钾制取氧气,应选用的发生装置是______
若用高锰酸钾制取氧气,应选用的发生装置是______![]() 填序号,下同
填序号,下同![]() ,在加入药品前,应首先______,该反应的化学方程式是______。
,在加入药品前,应首先______,该反应的化学方程式是______。
![]() 若要制取二氧化碳,在B装置中装有石灰石,那么a中应加入______
若要制取二氧化碳,在B装置中装有石灰石,那么a中应加入______![]() 填写试剂名称
填写试剂名称![]() 。该反应的化学方程式是______,检验该气体时应将气体通入______装置中。
。该反应的化学方程式是______,检验该气体时应将气体通入______装置中。
![]() 图中可用于固液反应制备气体的装置中不能使反应随时发生或停止的装置是______
图中可用于固液反应制备气体的装置中不能使反应随时发生或停止的装置是______![]() 填序号
填序号![]() ,原因是反应过程中若用止水夹夹紧橡胶管后,______。
,原因是反应过程中若用止水夹夹紧橡胶管后,______。
![]() 若用过氧化氢溶液制备
若用过氧化氢溶液制备![]() ,最好选用装置______
,最好选用装置______![]() 填序号
填序号![]() ,把E装满水,用排水法收集
,把E装满水,用排水法收集![]() 并测定气体体积应在______
并测定气体体积应在______![]() 填“b”或“c”
填“b”或“c”![]() 端连接上一个量筒。
端连接上一个量筒。
【答案】长颈漏斗 A 检查装置气密性 2KMnO4![]() K2MnO4 + MnO2 + O2↑ 稀盐酸
K2MnO4 + MnO2 + O2↑ 稀盐酸 ![]() D B 装置内的压强改变,但是不会实现固体和液体的分离 B b
D B 装置内的压强改变,但是不会实现固体和液体的分离 B b
【解析】
(1)仪器a是长颈漏斗;
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应物的状态是固体,反应条件是加热,属于固体加热型,故可选用的发生装置是A;在加入药品前,为防止装置漏气,应首先检查气密性,反应的化学方程式是:2KMnO4![]() K2MnO4 + MnO2 + O2↑;
K2MnO4 + MnO2 + O2↑;
(3)实验室中常用大理石或石灰石与稀盐酸反应来制取二氧化碳,大理石或石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳能使澄清的石灰水变浑浊,所以常用盛有澄清石灰水的装置D来检验;
(4)B装置内压强改变时,不会实现固体和液体的分离,所以不能使反应随时发生或停止的装置是B,原因是反应过程中若用止水夹夹紧橡胶管后,装置内的压强改变,但是不会实现固体和液体的分离;
(5)二氧化锰是粉末状,不能放在塑料片上,所以用过氧化氢溶液制备O2,最好选用装置B,可以节约药品,氧气密度比水小,不易溶于水,所以把F装满水,用排水法收集O2并测定气体体积,应在b端连接上一个量筒。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】实验室常用双氧水与二氧化锰混合来制取氧气,写出相关反应的化学方程式:_____,小王同学对“双氧水分解快慢的影响因素”进行了探究.
(提出问题)双氧水分解快慢的影响因素有哪些?
(猜想与假设)猜想一:可能与二氧化锰的形状有关;猜想二:可能与温度有关.
(设计并实验)小王同学用8mL3%的双氧水和二氧化锰进行了如下实验(反应进行10s时,H2O2均有剩余);
实验编号 | 温度℃ | 二氧化锰的形状(均取0.4cm) | 收集到氧气的体积/mL(时间均为10s) |
① | 20 | 颗粒状 | a |
② | 30 | 粉末状 | b |
③ | 30 | 颗粒状 | c |
④ | 20 | 粉末状 | d |
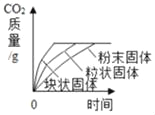
(1)欲探究温度对”双氧水分解快慢“是否有影响,应该比较_____和_____(填“a”“b”“c”或“d”)的大小;若粉末状二氧化锰催化效果好,那么_____>_____(填“a”“b”“c”或“d”)
(2)其他条件相同,双氧水浓度可能会影响催化效果,请你设计实验方案进行验证:_____.
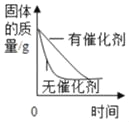
(3)小王同学还是用了压强传感器测不同质量二氧化锰对双氧水分解快慢的影响.他在8mL3%的双氧水中分别加入了0.03g,0.06g,0.08g,0.12g,0.24gMnO2.测得容器内压强的变化曲线如图所示(曲线的斜率表征催化反应的速率).请你观察图,并写出两条规律性结论:

①_____;
②_____.
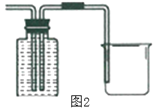
【题目】实验室通常利用如图装置制取氧气。
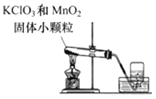
写出KClO3在MnO2作用下制取氧气的化学方程式______;
某化学兴趣小组在实验过程中发现有以下“异常”现象:
a.利用排空法收集氧气有异味;
b.颗粒状MnO2变得更细。
对此进行了以下探究:
探究(I)利用排空法收集的氧气有异味
查阅资料:KClO3在MnO2作用下分解生成氧气,经历了以下三个过程
①2KClO3+2MnO2![]() 2______+Cl2↑+O2↑
2______+Cl2↑+O2↑
②2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
③Cl2+K2MnO4![]() 2KCl+MnO2+O2↑;
2KCl+MnO2+O2↑;
(1)写出横线物质的名称______,其中Mn元素的化合价为______;
(2)猜测“利用排空法收集氧气有异味”的物质是______。
探究(Ⅱ)颗粒状MnO2变得更细
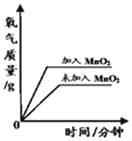
学习小组通过讨论猜测:是因为MnO2也参加了化学反应。小组同学共同设计实验并验证MnO2在该反应中作催化剂。
实验操作 | 实验现象 | 解释 | |
实验一 | 将KClO3加热至融化,伸入带火星的木条。 | 木条一段时间后复燃 | KClO3受热要分解产生氧气; |
实验二 | 加热MnO2,伸入带火星的木条 | ______ | MnO2受热不产生氧气; |
实验三 | 取适KClO3和2g的 ______ | 木条迅速复燃 | MnO2 ______ (填“加快”或“减慢”)KClO3的分解 |
实验结论:MnO2是KClO3受热分解的催化剂。
归纳反思:该小组的实验结论受到其他小组的质疑,为此该小组又补充以下实验:
(1)待试管完全冷却后,向实验三的试管中加蒸馏水,将混合物全部转移至烧杯,过滤(MnO2不溶于水,其他物质均能溶于水),洗涤沉淀,烘干,称量,目的是验证______;称量所得固体质量______;
(2)设计实验验证催化剂的另一个特点,实验方案______。