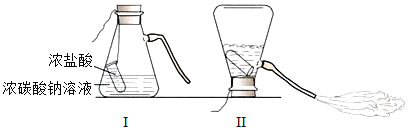
题目内容
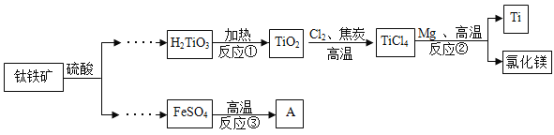
【题目】金属钛广泛用于航空航天工业、化工、医疗等领域,用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
请回答下列问题
(1)反应②需持续通入氩气,氩气的作用是_____________;
(2)反应①②③中属于分解反应的是____(填“①”“②”“③”);
(3)对反应③进行改进,可直接生产锂离子电池的电极材料LiFePO4,工艺流程如下图:
![]()
写出“高温煅烧”由FePO4制备LiFePO4的化学方程式______________________。
【答案】作保护气(或隔绝空气) ①③ 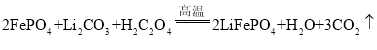
【解析】
(1)氩气是稀有气体,稀有气体化学性质不活泼,因此可用做保护气;
(2)由流程可知反应①为H2TiO3加热生成TiO2和水,是分解反应;反应②是TiCl4与Mg反应生成Ti和MgCl2,为置换反应;反应③为高温分解FeSO4,生成Fe2O3、SO2和SO3,因此为分解反应的是①③;
(3)根据流程可知该反应的反应物为FePO4、Li2CO3和H2C2O4,根据质量守恒定律中原子种类不变,可知在高温条件下,H元素转化为H2O、C元素转化为CO2,因此反应表达式为
![]() ,应用观察法配平得方程式为
,应用观察法配平得方程式为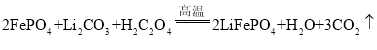 ;
;
故答案为:作保护气(或隔绝空气);①③;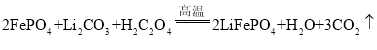 。
。

练习册系列答案
相关题目
【题目】同学们从山上采集到种石灰石,他们取120克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如表:
反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m/g | 110 | 100 | 90 | 80 | 76 | 76 | 76 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数。
(3)求用30g该石灰石能够产生多少质量的二氧化碳(写出计算过程)