题目内容
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究。
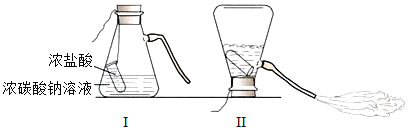
(提出问题)
废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质可能是NaCl、Na2CO3和HCl.
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl和HCl.
猜想4:废液中的溶质是______________
(讨论与交流)
小明认为猜想1无需验证就知道是错误的,他的理由是_____________。
(实验与结论)
(1)小亮同学为验证猜想2,取少量废液装入试管中,然后滴入酚酞溶液,发现酚酞溶液不变色,于是小亮认为猜想2正确。你认为他的结论__(填“正确”或“错误”)。理由____。
(2)小美为验证猜想3,用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试低上,测得pH=4,她认为猜想3 正确。对她的操作方法、测量结果及结论的评价,正确的是_________.
A 方法不正确,结果偏小,结论正确
B 方法不正确,结果偏大,结论正确
C 方法正确,结果偏大,结论正确
D 方法正确,结果偏小,结论不正确
(3)小丽为验证猜想4成立,选择了三种不同类别的物质,它们可以是__________、__________、________。
【答案】NaCl、Na2CO3 碳酸钠和盐酸会发生反应,不能共存 错误 含有盐酸的氯化钠溶液也不能使酚酞试液变色 B 盐酸 氯化钙 氢氧化钙
【解析】
根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应后溶质的情况要考虑反应物是否过量的问题;显酸性和显中性的溶液不能使酚酞试液变色,显碱性溶液能使酚酞试液变红色;测定溶液pH的方法是:用洁净干燥的玻璃棒蘸取溶液,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH;证明碳酸钠的存在,可以选择酸、碱和盐三种类别的物质,但必须产生明显的现象;进行分析作答。
猜想与假设:
盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,所以溶质一定有NaCl,还应考虑盐酸和碳酸钠是否过量的情况:
猜想2:恰好完全反应时废液中的溶质只有NaCl;
猜想3:盐酸过量时废液中的溶质是NaCl和HCl;
猜想4:碳酸钠过量时废液中的溶质是NaCl、Na2CO3;
讨论与交流:
猜想1无需验证就知道是错误的,理由是碳酸钠和盐酸要发生反应,不能共存;
实验与结论:
(1)小亮的结论错误,理由是含有盐酸的氯化钠溶液也不能使酚酞试液变色;
(2)测定溶液的酸碱度时,不能滴到湿润的pH试纸上,滴到湿润的pH试纸上时,酸性减弱,导致测定结果偏高;测定结果显酸性,说明猜想3正确;故选B;
(3)小丽为验证猜想4成立,即碳酸钠过量,选择三种不同类别的物质,都和碳酸钠反应产生明显的现象;可以选酸,如盐酸,盐酸和碳酸钠反应产生气体;可以选盐溶液,如氯化钙溶液,氯化钙和碳酸钠反应产生白色沉淀;可以选碱溶液,如氢氧化钙溶液,氢氧化钙和碳酸钠反应产生白色沉淀。

 阅读快车系列答案
阅读快车系列答案