题目内容
【题目】利用下列提供的仪器装置回答问题:
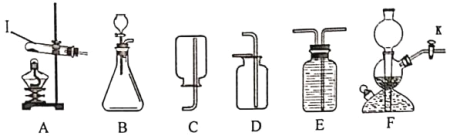
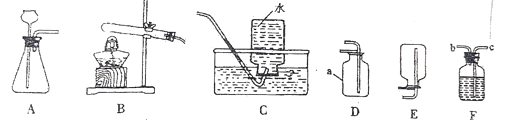
①仪器名称:I为________;
②实验室用氯酸钾和二氧化锰制取氧气,反应化学方程式为___________,反应基本类型为_________,可选择的收集装置为____________;
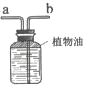
③实验室制取二氧化碳的反应化学方程式为___,为了便于控制反应的发生和停止,可选择发生装置为____,某同学利用如图收集二氧化碳,气体应从_______口进入(填“a”或“b”);
④如图 F,判断 F中反应是否在发生____(填“是”或“否”),实验结束后关闭活塞 K后的现象为___;氢能是最理想的能源,若将实验室用 F 装置制得的 0.1mol 氢气全部燃烧掉,大约可以释放出28.58kJ的热能,求燃烧掉0.1mol氢气需要氧气多少克?______(根据化学方程式计算)。
【答案】试管 2KClO3![]() 2KCl+3O2↑ 分解反应 DE CaCO3+2HCl→CaCl2+H2O+CO2↑ F a 是 气体继续产生,容器中液面下降,球形漏斗中液面上升,固液分离时反应停止 1.6
2KCl+3O2↑ 分解反应 DE CaCO3+2HCl→CaCl2+H2O+CO2↑ F a 是 气体继续产生,容器中液面下降,球形漏斗中液面上升,固液分离时反应停止 1.6
【解析】
①由图可知,仪器I名称为试管,故填试管。
②氯酸钾在二氧化锰作催化剂和加热的条件下反应生成氯化钾和氧气,故反应的化学方程式写为:2KClO3 ![]() 2KCl+3O2↑;
2KCl+3O2↑;
由化学方程式可知,该反应是一种物质反应生成两种物质,属于分解反应,故填分解反应;
氧气不溶于水,且密度大于空气的密度,所以收集氧气既能用排水法,也能用向上排空气法,故填DE。
③实验室制取二氧化碳的反应是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl→CaCl2+H2O+CO2↑;
装置F具有玻璃开关,可通过玻璃开关的开闭来控制反应的发生与停止,故填F;
二氧化碳的密度小于植物油和水的密度,所以二氧化碳应从短管进入瓶中,故填a。
④如图,装置F中的固体药品浸没在液体中,反应正在进行,故填是;
关闭活塞 K后,气体继续产生,由于气体不能导出,容器中的压强增大,容器中液面下降,球形漏斗中液面上升,固液分离时反应停止,故填气体继续产生,容器中液面下降,球形漏斗中液面上升,固液分离时反应停止;
解:0.1mol氢气的质量为0.1mol×2g/mol=0.2g
设需要氧气的质量为x,根据元素守恒可知
4:32=0.2g:x
x=1.6g
答:需要氧气的质量为1.6g。

【题目】如图所示装置(气密性良好),若先将甲中液体滴入丙中,观察到气球明显鼓起,一段 时间后恢复到原状;再将乙中液体滴入丁中,气球又明显鼓起。下列组合正确的是( )
选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
A | 过氧化氢溶液 | 二氧化锰 | 水 | 氯化钠 |
B | 稀硫酸 | 锌 | 盐酸 | 碳酸钠 |
C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
D | 水 | 氧化钙 | 盐酸 | 镁 |
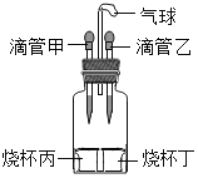
A. AB. BC. CD. D