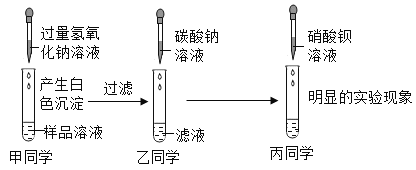
题目内容
【题目】工业上以氧化铁为原料制备铁酸铜的流程如下:
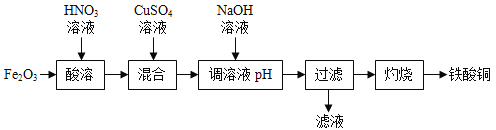
注:“灼烧”时反应的化学方程式为: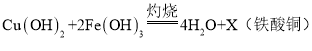
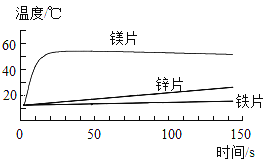
(1)“调溶液 pH”时需要不断测定溶液的 pH,最简单的方法是:用_____蘸取溶液,滴到pH 试纸上,把试纸显示的颜色与_____对照,读出该溶液的pH。
(2)“调溶液pH”时主要发生两个反应,其中之一是: CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,该反应属于_____(选填“置换”“复分解”“化合”或“分解”)反应。“灼烧”所得的铁酸铜化学式为_____。
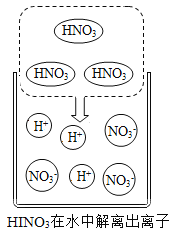
(3)HNO3在水中可解离出两种离子(见图)。请写出“酸溶”时反应的化学方程式:_____。
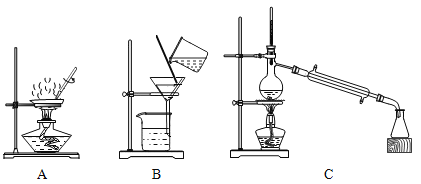
(4)“滤液”中的溶质除了Na2SO4之外,一定还有_____(填化学式)。欲通过蒸发的方法从“滤液”中获得它们的晶体,所需实验装置是_____(填字母)。
【答案】玻璃棒 标准比色卡 复分解 CuFe2O4 ![]() NaNO3 A
NaNO3 A
【解析】
Fe2O3用HNO3溶液进行酸溶,化学方程式为![]() ,再加入CuSO4溶液,得到Fe(NO3)3和CuSO4的混合溶液,再加入NaOH溶液,Fe(NO3)3和NaOH反应生成Fe(OH)3沉淀和NaNO3,CuSO4和NaOH反应生成Cu(OH)2沉淀和Na2SO4。过滤,滤液为NaNO3和Na2SO4的混合溶液,固体为Fe(OH)3和Cu(OH)2。固体经过灼烧生成铁酸铜和水,根据质量守恒定律,可推知铁酸铜的化学式为CuFe2O4,该反应的化学方程式为:
,再加入CuSO4溶液,得到Fe(NO3)3和CuSO4的混合溶液,再加入NaOH溶液,Fe(NO3)3和NaOH反应生成Fe(OH)3沉淀和NaNO3,CuSO4和NaOH反应生成Cu(OH)2沉淀和Na2SO4。过滤,滤液为NaNO3和Na2SO4的混合溶液,固体为Fe(OH)3和Cu(OH)2。固体经过灼烧生成铁酸铜和水,根据质量守恒定律,可推知铁酸铜的化学式为CuFe2O4,该反应的化学方程式为: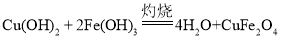 。
。
(1)测量溶液pH时,用玻璃棒蘸取溶液,滴到放在白瓷板或表面皿上的pH试纸上,把试纸显示的颜色与标准比色卡对照,读出该溶液的pH。注意不得将pH试纸伸入待测液中。
(2)CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,该反应是盐和碱反应生成盐和碱,并且有沉淀产生,符合复分解反应的特征,属于复分解反应。
(3)因为HNO3在水中可电离出的阳离子全部是H+,属于酸,根据酸的化学性质, Fe2O3和HNO3反应生成硝酸铁和水,化学方程式为:![]() 。
。
(4)根据分析可知,Fe(NO3)3和NaOH反应生成Fe(OH)3沉淀和NaNO3,CuSO4和NaOH反应生成Cu(OH)2沉淀和Na2SO4,因此“滤液”中的溶质除了Na2SO4之外,一定还有NaNO3;A装置是蒸发装置,B装置是过滤装置,C装置是蒸馏装置,要通过蒸发的方法从“滤液”中获得它们的晶体,需要使用蒸发装置,故选A。

【题目】“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
甲 | 乙 | 丙 | |
烧杯+稀盐酸质量 | 139g | 129g | 129g |
加入黄铜样品质量 | 20g | 24g | 20g |
充分反应后,烧杯+剩余物质质量 | 158.8g | 152.8g | 148.8g |
发生的反应化学方程式:Zn+2HCl=ZnCl2+H2↑,请回答下列问题:
(1)同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是____________。
(2)所用的稀盐酸的溶质质量分数。____________