题目内容
同学们在学习了酸碱盐的性质后,萌生了用身边的物质来制取新物质并研究物质性质的想法。请你参与其中,体验实验探究的快乐吧。
【粗产品制备】
课外化学兴趣小组的同学利用家里的纯碱溶液和贝壳为原料制备烧碱,按图所示流程进行实验,请你参与讨论并回答相关问题。
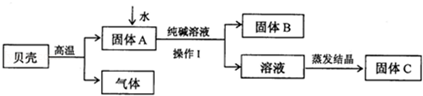
(1)贝壳高温煅烧时,发生反应的化学方程式是 ;
(2)操作Ⅰ是____________,该过程中用到的玻璃仪器有烧杯、 、玻璃棒;
(3)得到烧碱时发生反应的化学方程式为 ;
(4)得到的溶液存放在如图所示的 的瓶中(填A 或B)。

【粗产品成分分析】
将溶液蒸发结晶得到固体C,固体C中的成分有哪些呢?
甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH) 2 Na2CO3; 丁认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 ;
(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论 (填“正确”、“错误”或“无法确定”),理由是 ;
(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ;结论:由上述实验,你认为__________同学的实验结论是正确。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要虑 。
【定量分析】
(7)另称取10g上述样品C,放入盛有100g7.3%的稀盐酸的烧杯中,恰好完全反应,反应后将所得溶液蒸发,求得到的氯化钠固体质量(写出过程2分)。
【粗产品制备】
课外化学兴趣小组的同学利用家里的纯碱溶液和贝壳为原料制备烧碱,按图所示流程进行实验,请你参与讨论并回答相关问题。

(1)贝壳高温煅烧时,发生反应的化学方程式是 ;
(2)操作Ⅰ是____________,该过程中用到的玻璃仪器有烧杯、 、玻璃棒;
(3)得到烧碱时发生反应的化学方程式为 ;
(4)得到的溶液存放在如图所示的 的瓶中(填A 或B)。

【粗产品成分分析】
将溶液蒸发结晶得到固体C,固体C中的成分有哪些呢?
甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH) 2 Na2CO3; 丁认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 ;
(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论 (填“正确”、“错误”或“无法确定”),理由是 ;
(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ;结论:由上述实验,你认为__________同学的实验结论是正确。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要虑 。
【定量分析】
(7)另称取10g上述样品C,放入盛有100g7.3%的稀盐酸的烧杯中,恰好完全反应,反应后将所得溶液蒸发,求得到的氯化钠固体质量(写出过程2分)。
【粗产品制备】
(1)CaCO3 CaO + CO2↑;(2)过滤;漏斗(3)Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH (4)A
CaO + CO2↑;(2)过滤;漏斗(3)Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH (4)A
【粗产品成分分析】
NaOH Na2CO3;丙 ; Ca(OH)2与Na2CO3不共存;(5)错误 碳酸钠、氢氧化钙也显碱性(其他合理答案亦可);(6)Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;丁
【反思拓展】: 反应物的过量
【定量分析】(7)11.7g
(1)CaCO3
 CaO + CO2↑;(2)过滤;漏斗(3)Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH (4)A
CaO + CO2↑;(2)过滤;漏斗(3)Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH (4)A 【粗产品成分分析】
NaOH Na2CO3;丙 ; Ca(OH)2与Na2CO3不共存;(5)错误 碳酸钠、氢氧化钙也显碱性(其他合理答案亦可);(6)Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;丁
【反思拓展】: 反应物的过量
【定量分析】(7)11.7g
试题分析:(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3
 CaO + CO2↑;(2)操作Ⅰ是固液分离的过滤操作,该过程中用到的玻璃仪器有烧杯、漏斗、玻璃棒;(3)得到烧碱时发生反应的化学方程式为Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH;(4)得到的是氢氧化钠溶液故应存放在胶塞的试剂瓶中,故选择A的瓶中;【粗产品成分分析】根据物质的反应程度,讨论剩余情况,故丁认为可能含有NaOH Na2CO3;【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是Ca(OH)2与Na2CO3不共存;(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论错误,理由是碳酸钠、氢氧化钙的溶液也显碱性;(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;结论:由上述实验,你认为丁同学的实验结论是正确。【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否过量【定量分析】
CaO + CO2↑;(2)操作Ⅰ是固液分离的过滤操作,该过程中用到的玻璃仪器有烧杯、漏斗、玻璃棒;(3)得到烧碱时发生反应的化学方程式为Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH;(4)得到的是氢氧化钠溶液故应存放在胶塞的试剂瓶中,故选择A的瓶中;【粗产品成分分析】根据物质的反应程度,讨论剩余情况,故丁认为可能含有NaOH Na2CO3;【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是Ca(OH)2与Na2CO3不共存;(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论错误,理由是碳酸钠、氢氧化钙的溶液也显碱性;(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;结论:由上述实验,你认为丁同学的实验结论是正确。【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否过量【定量分析】(7)解:设生成氯化钠的质量为X
HCl ~ NaCl
36.5 58.5
100×7.3% X 1分
36.5 :100×7.3% = 58.5: X
X =11.7g 1分

练习册系列答案
相关题目