题目内容
甲、乙、丙三位同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:各取5.0g样品(样品中MgCl2、NaCl均匀分布)溶于一定量的水中得到25.0g溶液,再加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的质量如下表:
| 甲 | 乙 | 丙 | |
| 加入NaOH溶液的质量(g) | 35.0 | 40.0 | 45.0 |
| 反应得到沉淀的质量(g) | 2.5 | 2.9 | 2.9 |
(1)上述实验中,______同学所用的氢氧化钠溶液一定过量.
(2)计算乙同学实验后所得溶液(NaCl)溶质质量分数(结果精确到0.1%).
解:(1)由甲的实验数据可知,加入20.0g氢氧化钠溶液可生成1.45g沉淀;乙实验加入40.0g氢氧化钠溶液得到2.9g沉淀,而丙实验加入60.0g氢氧化钠溶液,得到沉淀质量仍为2.9g,因此可确定丙所用氢氧化钠溶液一定过量,且乙实验中氢氧化钠与氯化镁恰好完全反应;
(2)设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x,生成氯化钠的质量是y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58 117
x 2.9g y
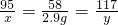
x=4.75g
y=5.85g
乙同学实验后所得溶液中的溶质的质量分数= ×100%=9.8%
×100%=9.8%
故答案为:(1)丙; (2)答:乙同学实验后所得溶液中的溶质的质量分数为9.8%;
分析:(1)分析表中生成沉淀与所加氢氧化钠溶液的关系,判断出所用的氢氧化钠溶液一定过量的一组实验;
(2)根据加入40.0g氢氧化钠溶液氯化镁恰好完全反应,由氢氧化镁沉淀的质量计算样品中氯化镁质量,和生成的氯化钠质量,乙同学实验中氢氧化钠与氯化镁恰好完全反应,反应后所得溶液为氯化钠溶液,其中氯化钠质量为样品中氯化钠与反应生成氯化钠质量和,据此分析解答即可;
点评:本题是一道有关物质组成的综合计算题,包括根据化学方程式的计算,有关溶液中溶质质量分数的计算,考查了学生根据实验数据分析反应情况的能力.
(2)设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x,生成氯化钠的质量是y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58 117
x 2.9g y
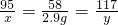
x=4.75g
y=5.85g
乙同学实验后所得溶液中的溶质的质量分数=
 ×100%=9.8%
×100%=9.8%故答案为:(1)丙; (2)答:乙同学实验后所得溶液中的溶质的质量分数为9.8%;
分析:(1)分析表中生成沉淀与所加氢氧化钠溶液的关系,判断出所用的氢氧化钠溶液一定过量的一组实验;
(2)根据加入40.0g氢氧化钠溶液氯化镁恰好完全反应,由氢氧化镁沉淀的质量计算样品中氯化镁质量,和生成的氯化钠质量,乙同学实验中氢氧化钠与氯化镁恰好完全反应,反应后所得溶液为氯化钠溶液,其中氯化钠质量为样品中氯化钠与反应生成氯化钠质量和,据此分析解答即可;
点评:本题是一道有关物质组成的综合计算题,包括根据化学方程式的计算,有关溶液中溶质质量分数的计算,考查了学生根据实验数据分析反应情况的能力.

练习册系列答案
相关题目
甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
试回答下列问题:
(1)上述实验中, 同学所用的氢氧化钠溶液一定过量.
(2)求原固体样品中氯化镁的质量分数.
(3)计算乙同学实验后所得溶液中的溶质的质量分数(计算结果保留小数点后一位).
| 甲 | 乙 | 丙 | |
| 加入氢氧化钠溶液质量(g) | 20.0 | 40.0 | 60.0 |
| 反应得到沉淀的质量(g) | 1.45 | 2.9 | 2.9 |
(1)上述实验中,
(2)求原固体样品中氯化镁的质量分数.
(3)计算乙同学实验后所得溶液中的溶质的质量分数(计算结果保留小数点后一位).

 (2007?石景山区一模)用如图所示装置干燥并收集某纯净气体,甲、乙、丙三位同学对该气体的组成有不同的认识,请你对他们的推测进行评价:
(2007?石景山区一模)用如图所示装置干燥并收集某纯净气体,甲、乙、丙三位同学对该气体的组成有不同的认识,请你对他们的推测进行评价: