题目内容
镁是一种用途广泛的金属材料,目前大部分镁都是利用从海水中提取的镁盐制取的.某校化学活动小组欲测定海水中氯化镁的含量,取海水样品200g,加入适量 氢氧化钠溶液,至恰好完全反应为止,称量所得沉淀物的质量为0.58g. 请你根据上述资料,回答下列问题:
(1)金属镁的物理性质有: .(答出一条即可)
(2)查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是 , .
(3)列式计算:上述200g海水样品中,所含MgCl2的质量是多少?
(提示:MgCl2+2NaOH=Mg(OH)2↓+2NaCl )
(1)金属镁的物理性质有:
(2)查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是
(3)列式计算:上述200g海水样品中,所含MgCl2的质量是多少?
(提示:MgCl2+2NaOH=Mg(OH)2↓+2NaCl )
考点:根据化学反应方程式的计算,金属的物理性质及用途,盐的化学性质
专题:有关化学方程式的计算
分析:(1)金属镁的物理性质有银白色固体/良好延展性、传导性/密度、硬度均较小/熔沸点较高 等;
(2)从海水中提取 MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,这样做的目的是采用化学沉淀法将海水中的镁元素予以富集、提取分离;
(3)根据氯化镁和氢氧化钠反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出MgCl2的质量.
(2)从海水中提取 MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,这样做的目的是采用化学沉淀法将海水中的镁元素予以富集、提取分离;
(3)根据氯化镁和氢氧化钠反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出MgCl2的质量.
解答:解:(1)金属镁的物理性质有银白色固体/良好延展性、传导性/密度、硬度均较小/熔沸点较高 等;
(2)从海水中提取 MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,这样做的目的是采用化学沉淀法将海水中的镁元素予以富集、提取分离;
(3)设海水样品中MgCl2的质量为x,则
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58
x 0.58g
=
,
得 x=0.95g
答:该海水样品中含有0.95g MgCl2.
答案(1)银白色固体;
(2)采用化学沉淀法将海水中的镁元素予以富集;提取分离
(3)该海水样品中含有0.95g MgCl2.
(2)从海水中提取 MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,这样做的目的是采用化学沉淀法将海水中的镁元素予以富集、提取分离;
(3)设海水样品中MgCl2的质量为x,则
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58
x 0.58g
| 95 |
| x |
| 58 |
| 0.58g |
得 x=0.95g
答:该海水样品中含有0.95g MgCl2.
答案(1)银白色固体;
(2)采用化学沉淀法将海水中的镁元素予以富集;提取分离
(3)该海水样品中含有0.95g MgCl2.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目
下列除去物质所含杂质(括号内的物质为杂质)的方法正确的是( )
| A、CO2(HCl)气体,通过NaOH溶液 |
| B、Fe(Cu)粉加入足量的硫酸铜溶液 |
| C、CaO(CaCO3),高温灼烧 |
| D、CO2(CO),点燃 |
下列对有关实验操作或现象的描述中,错误的是( )
| A、用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH |
| B、收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳 |
| C、向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色 |
| D、将碘水滴加在馒头片上,出现蓝色 |
构成下列物质的微粒是分子的是( )
| A、镁 | B、氯化钠 | C、液氧 | D、氖气 |
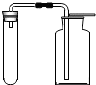 如图是初中化学实验室制取气体的一种简易装置,请回答以下问题:
如图是初中化学实验室制取气体的一种简易装置,请回答以下问题: