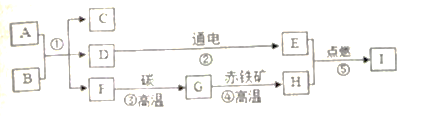
题目内容
【题目】以1-18号元素为研究对象,请回答下列问题:
(1)l~18号元素中最外层有2个电子的原子有______、Be、Mg(填元素符号)。
(2)氮化钠是科学家制备的一种重要的化合物,在室温时为晶体,在低于室温时会变成非晶体,高于87℃时会分解为钠单质及氮气,氮化钠的化学式是___________。
(3)某粒子的结构示意图为 (y≠0),当x-y=8时该粒子的符号为________。
(y≠0),当x-y=8时该粒子的符号为________。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。与N2O互为等电子体的粒子符号为_________。
【答案】He Na3N S2- CO2
【解析】
利用l~18号元素的结构示意图以及化合价与最外层电子数的关系解答。
(1) 根据l~18号元素的核外电子排布的规律知,最外层有2个电子的原子有:2号元素He,4号元素Be,12号元素Mg,故填:He;
(2)氮元素的质子数为7,根据核外电子排布规律,其原子最外层电子数为5,易得3个电子,形成8个电子的稳定结构,所以氮元素的化合价可显-3价,而金属钠通常显+1价,则氮化钠的化学式为Na3N,故填:Na3N;
(3)根据原子结构的特征:在原子中,质子数=核外电子总数,从结构示意图可知在原子中的等量关系:x=10+y,而此题的信息是x-y=8,即x=8+y,说明此粒子结构示意图为离子结构示意图,而在离子结构示意图中最外层是8个电子的稳定结构,所以y=8,代入等式知x=16,核外电子数为18个,质子数为16的元素是硫元素,所以此粒子是硫离子,符号为S2-,故填:S2-;
(4)具有相同原子数和电子数的分子或离子叫等电子体。N2O的原子数为3,电子数为22,而CO2的原子数为3,电子数为22,所以CO2与N2O互为等电子体。故填:CO2。

 名校课堂系列答案
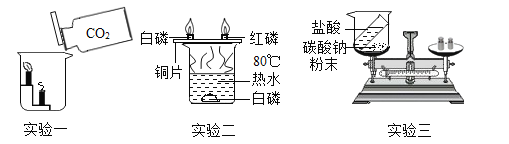
名校课堂系列答案【题目】请根据下列实验装置图,回答有关问题。

(1)图甲是实验室加热高锰酸钾制取氧气的发生装置,实验时应在试管口塞一团棉花,其作用是_____。试管中发生反应的符号表达式为_____,属于_____反应(反应类型)。
(2)图乙中标号仪器①的名称_____。
利用图乙进行下列实验:
I:开始先关闭K2,打开K1,片刻后观察到烧杯中蜡烛燃烧更剧烈,A中发生反应的符号表达式为_____,其中二氧化锰的作用是_____。
Ⅱ:然后关闭K1,打开K2,观察到烧杯中蜡烛燃烧不旺直至熄灭,B中发生反应的符号表达式为_____,蜡烛逐渐熄灭说明二氧化碳具有的化学性质是_____。
气体 | 药品 | 条件 |
①氢气 | 锌粒和稀硫酸 | 常温 |
②氯气 | 二氧化锰和浓盐酸 | 加热 |
③硫化氢 | 硫化亚铁固体和稀硫酸 | 常温 |
(3)下列三种气体能选用图乙中A作为发生装置的是_____(填序号)。
【题目】(1)甲、乙是常见元素的单质,A、B是常见的化合物,它们的反应表达式是甲+A=B+乙(式中各物质的化学计量数和反应条件已略去)。请回答:
①该反应的类型是_______________。
②若甲、乙为金属,且甲的化合物溶液为蓝色,写出反应的化学方程式____________________________。
③若乙为非金属单质,B中含有+3价金属元素,写出反应的化学方程式____________________________。
(2)如图所示。常温下,某无色液体X中加入一种固体Y,观察到气球涨大。猜测可能情况。
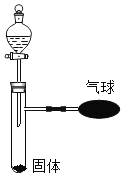
无色液体X的名称 | 固体Y的名称 | 反应的化学方程式 | |
__________ | __________ | _______ | |
__________ | __________ | ________ |
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()