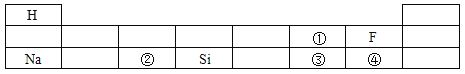
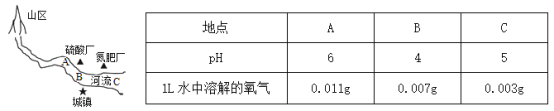
题目内容
【题目】某白色固体可能由CuSO、Na2SO4、Na2CO3、NaOH、BaCl2、NaCl中的一种或几种组成。为了探究该白色固体的成分,按照如图所示流程进行实验(碳酸镁为微溶物,本题中视为沉淀):
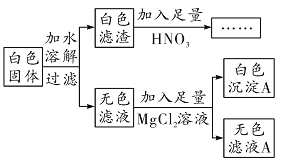
对于该白色固体成分有以下判断:
①加入足量稀硝酸后,若白色滤渣部分溶解,则该白色固体的组成有2种情况
②加入足量稀硝酸后,若白色滤渣未溶解,则该白色固体中一定含有Na2SO4、NaOH 、BaCl2
③无色滤液中一定含有NaCl
④向无色滤液A中加入稀硝酸酸化的AgNO3溶液,观察到有白色沉淀生成,可证明该白色固体中含有NaCl其中说法不正确的有
A.1种
B.2种
C.3种
D.4种
【答案】B
【解析】
根据无色滤液和白色滤渣可判断该固体中无CuSO4。生成的白色滤渣可能为BaSO4、BaCO3中的一种或两种,需要通过加入稀硝酸判断。向无色滤液中加入MgCl2产生白色沉淀,沉淀为Mg(OH)2或MgCO3。向白色滤渣中加入稀硝酸,沉淀部分消失,说明该成分为BaSO4和BaCO3的混合物,则原白色固体中一定有Na2SO4、Na2CO3、BaCl2,可能有NaCl和NaOH中的一种或两种,因此白色固体的组成情况有4种,①错误;
向白色滤渣中加入稀硝酸,沉淀不溶解,说明沉淀为BaSO4,因此白色沉淀A一定为Mg(OH)2故白色固体中一定含有Na2SO4、BaCl2、NaOH,②正确;
由以上分析可知,白色固体中一定含有BaCl2可能含有Na2SO4或Na2CO3中的一种或两种,BaCl2与两者反应会生成NaCl,③正确;
向无色滤液A中加入稀硝酸酸化的AgNO3溶液,有白色沉淀生成,证明滤液中含有氯离子,但是加入的MgCl2溶液中含有氯离子,且BaCl2和Na2SO4或Na2CO3反应生成的NaCl中也会含有氯离子,因此无法证明白色固体中是否有NaCl存在,④错误。
故选:B。