题目内容
某校研究性学习小组对采用分解过氧化氢溶液制取氧气进行了实验探究.Ⅰ、探究分解过氧化氢溶液的快慢和方法
| 实验① | 在试管中加入5mL 5%的过氧化氢溶液 |
| 实验② | 在试管中加入5mL 5%的过氧化氢溶液,并微微加热 |
| 实验③ | 在试管中加入5mL 5%的过氧化氢溶液,并加入少量MnO2 |
(1)上述三个实验中过氧化氢溶液分解速度最快的是 (填实验编号).
(2)在实验①中,如果加入少量FeCl3溶液,观察到试管中溶液立即产生气泡,这表明FeCl3在这一反应中起到 作用.
(3)在实验②中,检验过氧化氢分解得到氧气的方法是 .
Ⅱ.探究实验室分解过氧化氢溶液制取氧气
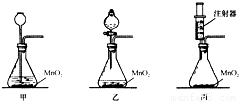
请你对下面实验室用分解过氧化氢溶液制取氧气的三个实验装置进行分析,并回答:
(1)上述甲、乙和丙三种装置,从实验药品的利用率和对气体的控制等角度来考虑,你认为实验装置 相对较好.
(2)收集一瓶氧气可采取的方法有 (填序号).
A排水集气法 B.向上排空气法 C.向下排空气法
(3)在实验丙中,用注射器取过氧化氢溶液30mL(密度约为l g/mL),向锥形瓶中加入少量MnO2,按图装配好仪器并称量,总质量为l47.6g,当将30mL过氧化氢溶液缓慢注入锥形瓶中直到无气体放出为止(假定过氧化氢已完全分解,水蒸气逸出忽略不计),称得该装置的总质量为146.0g.对上述数据处理并计算,该过氧化氢溶液的质量分数约为 (结果精确到0.1%).
【答案】分析:Ⅰ、(1)根据反应条件和二氧化锰在过氧化氢分解中的作用分析解答;
(2)实验①中,常温分解生成氧气的量很少,如果加入少量FeCl3溶液,观察到试管中溶液立即产生气泡,这表明FeCl3能加快过氧化氢的反应速率,在反应中起到催化作用;
(3)检验过氧化氢分解是否得到氧气,可用带火星的木条伸入试管内观察是否复燃进行判断;
Ⅱ、(1)甲装置中双氧水与二氧化锰一旦接触则须反应完,无法让反应终止,浪费药品;乙装置通过分液漏斗可控制液体的滴加速度,节约药品;丙装置通过注射器添加双氧水来控制反应速率,并节省药品,提高了药品的利用率,同时 将注射器废物利用,剩余的双氧水易于处理;
(2)据氧气的密度和溶解性选择收集方法;
(3)据质量守恒定律可知,装置减少的质量即是反应生成氧气的质量,据氧气的质量结合方程式可计算出过氧化氢溶液中溶质的质量,并进而计算出溶质的质量分数.
解答:解:Ⅰ、(1)实验①中,常温分解生成氧气的量很少;实验②,对试管稍微加热,温度升高,化学反应速率加快,过氧化氢分解速率稍微加快;实验③中加入少量MnO2,二氧化锰是过氧化氢分解的催化剂,可加快分解速率,加入后过氧化氢会迅速分解,所以反应速度最快的是③;
(2)实验①中,常温分解生成氧气的量很少,如果加入少量FeCl3溶液,观察到试管中溶液立即产生气泡,这表明FeCl3能加快过氧化氢的反应速率,在反应中起到催化剂的作用;
(3)检验过氧化氢分解是否氧气,可用带火星的木条伸入试管内观察是否复燃进行判断;
Ⅱ、(1)甲装置中双氧水与二氧化锰一旦接触则须反应完,无法让反应终止,浪费药品;乙装置通过分液漏斗可控制液体的滴加速度,节约药品;丙装置通过注射器添加双氧水来控制反应速率,剩余双氧水易于处理,节省了药品,提高了药品的利用率,同时将注射器废物利用;
(2)氧气的密度比空气大且不易溶于水,故可用向上排空气法或排水法收集;
(3)据质量守恒定律可知,反应生成氧气的质量是:l47.6g-146.0g=1.6g
设过氧化氢溶液中溶质的质量为x
2H2O2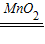 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
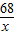 =
=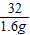
x=3.4g
则过氧化氢溶液中溶质的质量分数是: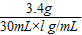 ×100%≈11.3%;
×100%≈11.3%;
故答案为:
I.(1)③; (2)催化;(3)用带火星的木条伸人试管内,若木条复燃,表明有氧气放出;
Ⅱ.(1)丙; (2)AB;(3)11.3%.
点评:了解过氧化氢制取氧气的反应原理,氧气的性质等知识,并能结合题意灵活分析解答问题,本题重在考查学生对知识的应用能力.
(2)实验①中,常温分解生成氧气的量很少,如果加入少量FeCl3溶液,观察到试管中溶液立即产生气泡,这表明FeCl3能加快过氧化氢的反应速率,在反应中起到催化作用;
(3)检验过氧化氢分解是否得到氧气,可用带火星的木条伸入试管内观察是否复燃进行判断;
Ⅱ、(1)甲装置中双氧水与二氧化锰一旦接触则须反应完,无法让反应终止,浪费药品;乙装置通过分液漏斗可控制液体的滴加速度,节约药品;丙装置通过注射器添加双氧水来控制反应速率,并节省药品,提高了药品的利用率,同时 将注射器废物利用,剩余的双氧水易于处理;
(2)据氧气的密度和溶解性选择收集方法;
(3)据质量守恒定律可知,装置减少的质量即是反应生成氧气的质量,据氧气的质量结合方程式可计算出过氧化氢溶液中溶质的质量,并进而计算出溶质的质量分数.
解答:解:Ⅰ、(1)实验①中,常温分解生成氧气的量很少;实验②,对试管稍微加热,温度升高,化学反应速率加快,过氧化氢分解速率稍微加快;实验③中加入少量MnO2,二氧化锰是过氧化氢分解的催化剂,可加快分解速率,加入后过氧化氢会迅速分解,所以反应速度最快的是③;
(2)实验①中,常温分解生成氧气的量很少,如果加入少量FeCl3溶液,观察到试管中溶液立即产生气泡,这表明FeCl3能加快过氧化氢的反应速率,在反应中起到催化剂的作用;
(3)检验过氧化氢分解是否氧气,可用带火星的木条伸入试管内观察是否复燃进行判断;
Ⅱ、(1)甲装置中双氧水与二氧化锰一旦接触则须反应完,无法让反应终止,浪费药品;乙装置通过分液漏斗可控制液体的滴加速度,节约药品;丙装置通过注射器添加双氧水来控制反应速率,剩余双氧水易于处理,节省了药品,提高了药品的利用率,同时将注射器废物利用;
(2)氧气的密度比空气大且不易溶于水,故可用向上排空气法或排水法收集;
(3)据质量守恒定律可知,反应生成氧气的质量是:l47.6g-146.0g=1.6g
设过氧化氢溶液中溶质的质量为x
2H2O2
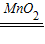 2H2O+O2↑
2H2O+O2↑68 32
x 1.6g
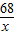 =
=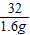
x=3.4g
则过氧化氢溶液中溶质的质量分数是:
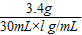 ×100%≈11.3%;
×100%≈11.3%;故答案为:
I.(1)③; (2)催化;(3)用带火星的木条伸人试管内,若木条复燃,表明有氧气放出;
Ⅱ.(1)丙; (2)AB;(3)11.3%.
点评:了解过氧化氢制取氧气的反应原理,氧气的性质等知识,并能结合题意灵活分析解答问题,本题重在考查学生对知识的应用能力.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
 某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.
某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.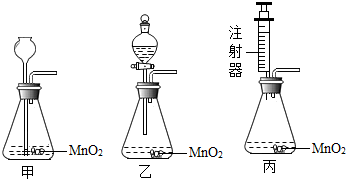 (2010?永州)某校研究性学习小组对采用分解过氧化氢溶液制取氧气进行了实验探究.
(2010?永州)某校研究性学习小组对采用分解过氧化氢溶液制取氧气进行了实验探究. 某校研究性学习小组对汉江某段水质的状况进行相关的调查研究.
某校研究性学习小组对汉江某段水质的状况进行相关的调查研究. 某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.
某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.