题目内容
(7分)应用所学知识,回答下列有关金属的问题:
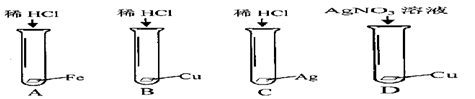
(1)将锌、铜、铁三种金属分别投入到足量的稀硫酸中,反应最快的是 ,不能反应的是 ,三种金属由强到弱的顺序是 。
(2)将一根生锈的铁钉投入到足量的稀盐酸中,观察到铁锈逐渐溶解,溶液由无色变为黄色,其原因是 (用化学方程式回答),一段时间后有无色气体产生,其原因是 (用化学方程式回答)。
(3)镁条在空气中燃烧,不足以证明镁能够和氧气反应,其理由及需补充一个实验来证明镁能够和氧气反应是 。
(1)将锌、铜、铁三种金属分别投入到足量的稀硫酸中,反应最快的是 ,不能反应的是 ,三种金属由强到弱的顺序是 。
(2)将一根生锈的铁钉投入到足量的稀盐酸中,观察到铁锈逐渐溶解,溶液由无色变为黄色,其原因是 (用化学方程式回答),一段时间后有无色气体产生,其原因是 (用化学方程式回答)。
(3)镁条在空气中燃烧,不足以证明镁能够和氧气反应,其理由及需补充一个实验来证明镁能够和氧气反应是 。
(1)锌;铜;锌铁铜
(2)Fe2O3+6HCl→2FeCl3+3H2O;Fe+2HCl→FeCl2+H2↑
(3)因为空气中含有氮气等其他气体,所以无法证明镁是和氧气发生反应。需要补充镁在纯氧中燃烧的实验(2分)
(2)Fe2O3+6HCl→2FeCl3+3H2O;Fe+2HCl→FeCl2+H2↑
(3)因为空气中含有氮气等其他气体,所以无法证明镁是和氧气发生反应。需要补充镁在纯氧中燃烧的实验(2分)
试题分析:(1)将锌、铜、铁三种金属分别投入到足量的稀硫酸中,反应最快的是锌,不能反应的是铜,三种金属由强到弱的顺序是锌、铁、铜。
(2)将一根生锈的铁钉投入到足量的稀盐酸中,观察到铁锈逐渐溶解,溶液由无色变为黄色,其原因是Fe2O3+6HCl=2FeCl3+3H2O;
一段时间后有无色气体产生,其原因是Fe+2HCl=FeCl2+H2↑;
(3)镁条在空气中燃烧,不足以证明镁能够和氧气反应,其理由及需补充一个实验来证明镁能够和氧气反应,是因为空气中含有氮气等其他气体,所以无法证明镁是和氧气发生反应。需要补充镁在纯氧中燃烧的实验
点评:金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
在金属活动性顺序中,氢前的金属能与酸发生置换反应,且位置越靠前,反应越剧烈;位置在前的金属能把位于其后的金属从其盐溶液中置换出来。
书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。

练习册系列答案
相关题目