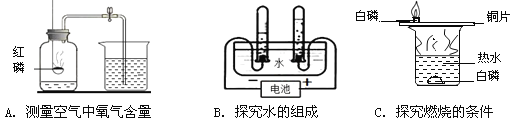
题目内容
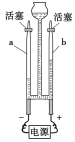
【题目】小芳设计了如下气体制取与性质验证的组合装置。打开分液漏斗活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中。请看图回答问题:
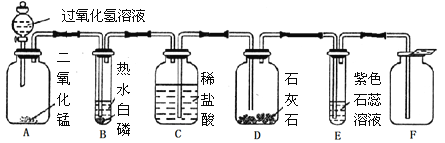
(1)A中发生反应的化学方程式为 。
(2)B中白磷能够在水下燃烧的原因是 。
(3)D中发生反应的化学方程式为 。
(4)E中的实验现象是 。
(5)用F装置收集气体的依据是 。
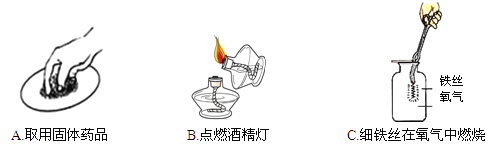
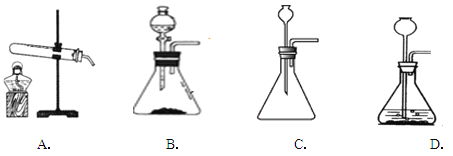
(6)实验室用块状固体碳化钙与水反应,制取乙炔(C2H2)气体,该反应比二氧化锰催化过氧化氢分解更加激烈,下列供选的气体发生装置中最合适的是: (填字母)
【答案】(1)2H2O2![]() 2H2O+O2↑(2分);(2)提供了氧气 ;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑(2分);(4)溶液变红;(5)CO2的密度大于空气的密度;(6)B;
2H2O+O2↑(2分);(2)提供了氧气 ;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑(2分);(4)溶液变红;(5)CO2的密度大于空气的密度;(6)B;
【解析】
试题分析:该题是过氧化氢在二氧化锰的催化下生成氧气,氧气和热水中的白磷反应放出大量的热,使试管内的气体压强增大将稀盐酸压入装有石灰石的试管,稀盐酸和石灰石反应生成二氧化碳,生成的二氧化碳进入紫色石蕊溶液使溶液变红,然后用F装置来吸收二氧化碳;
(1)A中的反应是过氧化氢的分解;(2)水中的白磷能燃烧是因为温度达到了着火点又接触了氧气;(3)D中是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;(4)二氧化碳和水化合生成碳酸,碳酸能使紫色石蕊溶液变红;(5)二氧化碳的密度比空气大,可以用向上排空气法收集;(6)反应物是固体和液体,反应条件是常温,且反应很剧烈,故应该选择B装置,可以用分液漏斗来控制滴加液体的速率来控制反应的速率;

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】(5分)实验室有一瓶没有标明质量分数的氯化钠溶液,为了对氯化钠溶液的质量分数进行分析。甲、乙、丙三位同学分别进行实验.他们的实验数据如下,请仔细观察分析,回答下列问题。
甲 | 乙 | 丙 | |
所取氯化钠溶液的质量(g) | 100 | 50 | 50 |
加入硝酸银溶液的质量(g) | 50 | 50 | 75 |
反应后所得沉淀物的质量(g) | 14.35 | 14.35 | 14.35 |
(1)上述反应的化学方程式为___________;
(2)求解50g硝酸银溶液中硝酸银质量(x)的比例式________;
(3)此氯化钠溶液中溶质的质量分数为____________;
(4)用23.4%的浓氯化钠溶液配制40g上述氯化钠溶液,需要浓氯化钠溶液的质量为___________;
(5)乙同学实验结束后,将反应后的溶液蒸发掉0.65g水,最终所得溶液的溶质质量分数为__________。