题目内容
制取氧气
讨论:
(1)
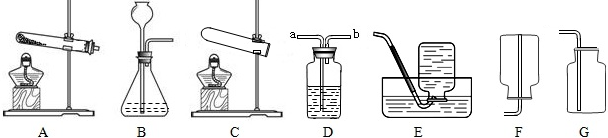
在图1和图2所示装置中,使用了哪些仪器?(2)
哪部分是气体发生装置,哪部分是气体收集装置?(3)
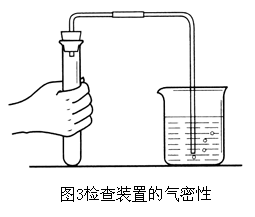
如何检查气体发生装置的气密性?(4)
为什么可以用排水法收集氧气?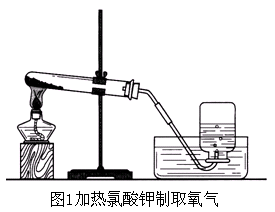

实验:
(1)
检查装置的气密性.如图3所示,用手紧握试管,观察水中的导管口有没有气泡冒出.如果有气泡冒出,说明装置不漏气(为什么?);如果没有气泡冒出,要仔细找原因,如是否应塞紧或更换橡胶塞,直至不漏气后才能进行实验.(2)
装置如图2所示①,检查过气密性之后在试管中装入少量高锰酸钾,并在试管口放一团棉花②,用带有导管的塞子塞紧管口.把试管口略向下倾斜③固定在铁架台上.(3)
将两个集气瓶分别盛满水,并用玻璃片盖住瓶口.然后把盛满水的瓶子连同玻璃片一起倒立在盛水的水槽内.(4)
给试管加热.先使酒精灯火焰在试管下方来回移动,让试管均匀受热,然后对高锰酸钾所在的部位加热.(5)
导管口开始有气泡放出时,不宜立即收集(为什么?),当气泡连续地并比较均匀地放出时,再把导管口伸入盛满水的集气瓶里.等瓶子里的水排完以后,在水面下用玻璃片盖住瓶口.小心地把瓶子移出水槽,正放在桌子上.用同样的方法再收集一瓶氧气(瓶中留有少量水).(6)
停止加热时,先要把导管移出水面,然后再熄灭酒精灯.(如果先熄灭酒精灯,可能会造成什么后果?)
答案:略
解析:
解析:
|
制取氧气 (1) 在图1和图2中所使用的仪器有:试管、酒精灯、铁架台、集气瓶、水槽、导气管等.(2) 图中左半部分是气体发生装置,右半部分是气体收集装置.(3) 将导管一端伸入水中,用手紧握试管,如果导管口有气泡冒出,说明装置不漏气(气体受热膨胀).夏季或室内温差较小时,还可用酒精灯稍稍加热.(4) 氧气不易溶于水,故可用排水法收集氧气.实验室用高锰酸钾制取氧气的操作步骤: ①检查装置的气密性;②将药品装入试管,用带导管的单孔橡皮塞塞紧试管;③将试管固定在铁架台上;④点燃酒精灯,先使试管均匀受热后,对准试管中的药品部位加热;⑤用排水法收集氧气;⑥收集完毕,将导管撤离水槽;⑦熄灭酒精灯. 以上步骤可概括为“查”“装”“定”“点”“收”“离”“熄” 7个字,可用语音记为:“茶庄定点收利息”.检验方法:将带火星的木条伸入瓶中,如果木条复燃,说明瓶内气体是氧气. 验满方法: a.用向上排空气法收集时,将带火星的木条放在瓶口,如果木条复燃,说明瓶内氧气已满.b.用排水法收集时,当气泡从瓶口冒出时,说明该瓶内氧气已满. |

练习册系列答案
相关题目