题目内容
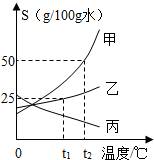 甲、乙、丙三种物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种物质的溶解度曲线如图所示,请回答:(1)0℃时,三种物质溶解度的大小关系是
(2)t2℃时,将30g固体甲加入到50g水中,充分搅拌后所得溶液的溶质质量分数为
(3)若甲中含有少量乙,应用
(4)欲配制20%的乙溶液,温度(T) 应满足
分析:(1)据溶解度曲线可比较同一温度时不同物质的溶解度大小;
(2)据该温度下甲的溶解度及 溶质的质量分数计算方法解答;
(3)据甲、乙的溶解度受温度影响情况分析解答;
(4)据饱和时质量分数的计算式
×100%分析解答.
(2)据该温度下甲的溶解度及 溶质的质量分数计算方法解答;
(3)据甲、乙的溶解度受温度影响情况分析解答;
(4)据饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
解答:解:(1)从溶解度曲线可知:0℃时它们的溶解度大小顺序是丙>乙>甲(或甲<乙<丙);
(2)t2℃时甲的溶解度是50g,所以将30g固体加入到50g水中最多溶解25g,所以充分搅拌后所得溶液的溶质质量分数为:
×100%≈33.3%;
(3)甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以甲物质中混有少量的乙物质,可以采用降温结晶或冷却热饱和溶液的方法分离提纯;
(4)根据:饱和溶液的质量分数计算:
×100%,设溶质质量分数为200%的乙物质溶液正好饱和,该温度下的溶解度是x则:
×100%=20%,解得x=25g,因为在t1℃正好是25g,所以要配制20%的乙物质溶液,必须大于t1℃才行;
故答案为:(1)丙>乙>甲(或甲<乙<丙);
(2)33.3%;
(3)降温结晶(或冷却热饱和溶液);
(4)≥t1℃.
(2)t2℃时甲的溶解度是50g,所以将30g固体加入到50g水中最多溶解25g,所以充分搅拌后所得溶液的溶质质量分数为:
| 25g |
| 75g |
(3)甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以甲物质中混有少量的乙物质,可以采用降温结晶或冷却热饱和溶液的方法分离提纯;
(4)根据:饱和溶液的质量分数计算:
| 溶解度 |
| 溶解度+100g |
| x |
| 100g+x |
故答案为:(1)丙>乙>甲(或甲<乙<丙);
(2)33.3%;
(3)降温结晶(或冷却热饱和溶液);
(4)≥t1℃.
点评:解答本题的关键是要知道溶解度曲线表示的意义,饱和溶液中溶质质量分数的计算,溶解度大小的比较,并结合题意分析解答.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
 24、甲.乙.丙三种物质的溶解度曲线如图所示,据图回答:
24、甲.乙.丙三种物质的溶解度曲线如图所示,据图回答: (2008?徐汇区一模)如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据右图回答:
(2008?徐汇区一模)如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据右图回答: (2012?天津)甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题:
(2012?天津)甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题: (2013?武汉)如图是甲、乙、丙三种物质的溶解度曲线.
(2013?武汉)如图是甲、乙、丙三种物质的溶解度曲线. (2013?文昌一模)如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液中分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(2013?文昌一模)如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液中分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题: