题目内容
【题目】(二)铁的化合物应用
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁。
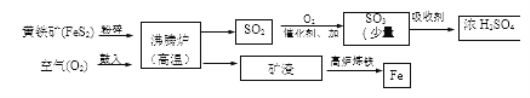
【1】工业上将黄铁矿粉碎的目的是____________________。
【2】生产硫酸后的尾气中含有SO2,如直接排放可能会造成环境问题是__________________。
【3】高炉炼铁的化学方程式为__________________________。
【4】150吨含FeS2 80%的黄铁矿理论上最多可以制得98%的浓硫酸________________吨。
【答案】
【1】 增大反应物接触面积,加快反应速率(或提高黄铁矿的利用率或使反应更加充分等)
【2】 酸雨
【3】 Fe2O3+3CO![]() 2Fe+3CO
2Fe+3CO
【4】 200
【解析】
增大反应物之间的接触面积可加快反应速率;化学反应遵守质量守恒定律;通过桥梁找出已知量与未知量之间的质量关系,然后进行计算即可。
【1】反应物之间的接触面积越大,反应速率越快。
【2】二氧化硫属于空气污染物,当空气中二氧化硫含量较高时,如果下雨,会形成酸雨,腐蚀建筑物、使树木枯萎等。
【3】化学反应前后原子种类不变、各种原子个数相等,Fe2O3+3CO ![]() 2Fe+3CO2 。
2Fe+3CO2 。
【4】根据化学反应前后硫元素质量不变可知,FeS2~2SO2~2SO3~2H2SO4,设150吨含FeS2 80%的黄铁矿理论上最多可以制得98%的浓硫酸的质量为x,则
FeS2 ~ 2H2SO4
120 196
150t×80% x×98%
![]() =
=![]() ,解得x=200t
,解得x=200t

练习册系列答案
相关题目