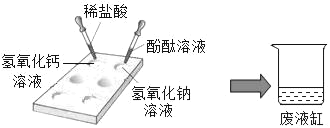
题目内容
【题目】通过下图所示实验得出的结论中正确的是( )
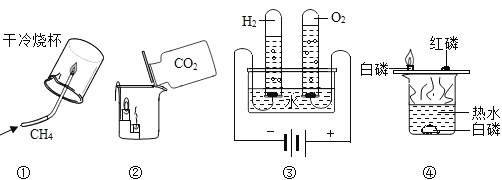
①既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
②既说明二氧化碳密度比空气大,又说明二氧化碳不燃烧也不支持燃烧
③既说明水分解能产生氢气和氧气,又说明水是由H、O两种元素组成
④既可探究可燃物的燃烧条件,又说明白磷的着火点比红磷低
A. ①②③B. ①③④C. ②③④D. ①②③④
【答案】C
【解析】
① 甲烷燃烧,烧杯内壁有水雾生成,说明甲烷具有可燃性,根据质量守恒定律又说明甲烷中含有氢元素,但不能确定是否含有碳元素,故①错误;
② 烧杯内的蜡烛由低到高依次熄灭,既说明二氧化碳密度比空气大,又说明二氧化碳不燃烧也不支持燃烧,故②正确;
③ 水通电分解产生气体,以检验是氧气和氢气,说明了水分解能产生氢气和氧气,氧气是由氧元素组成,氢气是由氢元素组成,在化学变化中元素的种类不变,说明了水是由H、O两种元素组成,故③正确;
④铜片上白磷燃烧红磷不燃烧,说明了白磷着火点较低,同时也说明燃烧需要温度达到可燃物的着火点;铜片上白磷与水中白磷相比,可得知燃烧需要与氧气接触。既可探究可燃物的燃烧条件,又说明白磷的着火点比红磷低,故④正确。所示实验得出的结论中正确的是②③④。故选C。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请计算:
(1)若要清洗1000kg的这种石油产品,需要______kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,可以节约多少经费?已知工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 1.00 | 6.00 |
(3)请画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。______
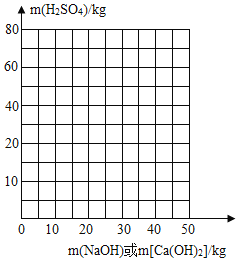
(4)将反应后生成的硫酸钙回收,在一定条件下加入高温硫酸盐还原菌,可以将SO42-离子转化生成H2S气体,然后用以硫酸的生产工业。不考虑整个过程中硫元素的损失,若将(2)中产生的硫酸钙全部转化,可生产H2S的质量为______kg。