题目内容
(2012?鄂州)氢化钙(常温下呈固态,能与水迅速反应放出大量的热,同时生成氢气.
(1)CaH2中氢元素的化合价为
(2)现有下列装置,用以实验室获得少量的氢气

①在上述装置中
②若要制取较干燥、纯净的H2,在上述装置中除发生装置外不可选用的装置是
(1)CaH2中氢元素的化合价为
-1
-1
价,CaH2与水反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑
CaH2+2H2O=Ca(OH)2+2H2↑
.(2)现有下列装置,用以实验室获得少量的氢气

①在上述装置中
A或B
A或B
(填字母)装置可用作氢气的发生装置.若以CaH2作原料制取少量H2,则选用A
A
(填字母)发生装置较为合理,不选用另一装置的理由是B装置不能控制反应的速度,A装置能随时控制反应的发生和停止
B装置不能控制反应的速度,A装置能随时控制反应的发生和停止
.②若要制取较干燥、纯净的H2,在上述装置中除发生装置外不可选用的装置是
E、H
E、H
(填字母)分析:实验室是用锌和稀硫酸在常温下制氢气的,如果用氢化钙和水反应,常温下也能进行,因此不需要加热,氢气的密度比空气的小,难溶于水,因此可以用向下排空气法和排水法收集.氢氧化钠固体和浓硫酸与氢气都不反应,因此都可以干燥氢气;因为要制取较干燥、纯净的H2,因此不能用排水法收集;氢气的密度比空气的小,因此不能用向上排空气法收集.
解答:解:(1)CaH2中,钙元素的化合价是+2价,因此氢元素的化合价为-1价;CaH2与水反应生成氢氧化钙和氢气,配平即可;故答案为:-1;CaH2+2H2O=Ca(OH)2+2H2↑;
(2)实验室是用锌和稀硫酸在常温下制氢气的,如果用氢化钙和水反应,常温下也能进行,因此不需要加热;若以CaH2作原料制取少量H2,则选用A,因为B装置不能控制反应的速度,A装置能随时控制反应的发生和停止;因为要制取较干燥、纯净的H2,因此不能用排水法收集;氢气的密度比空气的小,因此不能用向上排空气法收集.故答案为:①A或B;A;B装置不能控制反应的速度,A装置能随时控制反应的发生和停止;②E、H
(2)实验室是用锌和稀硫酸在常温下制氢气的,如果用氢化钙和水反应,常温下也能进行,因此不需要加热;若以CaH2作原料制取少量H2,则选用A,因为B装置不能控制反应的速度,A装置能随时控制反应的发生和停止;因为要制取较干燥、纯净的H2,因此不能用排水法收集;氢气的密度比空气的小,因此不能用向上排空气法收集.故答案为:①A或B;A;B装置不能控制反应的速度,A装置能随时控制反应的发生和停止;②E、H
点评:本题考查的是氢气的制取装置和收集装置的选择,还考查了化学方程式的书写和气体的干燥.气体的制取装置的选择与反应物的状态和反应的条件有关;收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目
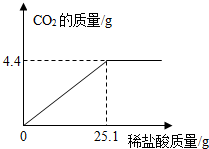 (2012?鄂州)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如下图所示.(有关反应:NaHCO3+HCl=NaCl+H2O+CO2↑)
(2012?鄂州)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如下图所示.(有关反应:NaHCO3+HCl=NaCl+H2O+CO2↑)