题目内容
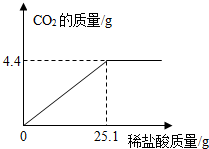 (2012?鄂州)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如下图所示.(有关反应:NaHCO3+HCl=NaCl+H2O+CO2↑)
(2012?鄂州)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如下图所示.(有关反应:NaHCO3+HCl=NaCl+H2O+CO2↑)求:(1)样品中碳酸氢钠的质量分数.
(2)恰好完全反应时,所得溶液中溶质的质量分数.
分析:碳酸氢钠与盐酸反应,生成氯化钠、水和二氧化碳;根据质量关系图,当加入25.1稀盐酸时恰好完全反应,放出气体二氧化碳的质量为4.4g;
(1)样品中碳酸氢钠的质量分数=
×100%,因此,需要根据化学方程式,由产生二氧化碳气体的质量计算样品中碳酸氢钠的质量;
(2)恰好完全反应时所得溶液为氯化钠溶液,其中溶质氯化钠由原混合物中的氯化钠和反应生成的氯化钠两部分所构成;因此计算溶质质量时需要计算出原有氯化钠及后来生成氯化钠的质量;溶液质量可利用质量守恒解决.
(1)样品中碳酸氢钠的质量分数=
| 样品中碳酸氢钠质量 |
| 样品质量10g |
(2)恰好完全反应时所得溶液为氯化钠溶液,其中溶质氯化钠由原混合物中的氯化钠和反应生成的氯化钠两部分所构成;因此计算溶质质量时需要计算出原有氯化钠及后来生成氯化钠的质量;溶液质量可利用质量守恒解决.
解答:解:设样品中碳酸氢钠的质量为x,生成氯化钠的质量为y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g
=
=
x=8.4g
y=5.85g
样品中碳酸氢钠的质量分数=
×100%=84%
恰好完全反应时,所得溶液中溶质的质量分数=
×100%=24.3%
答:(1)样品中碳酸氢钠的质量分数约为84%;
(2)恰好完全反应时,所得溶液中溶质的质量分数为24.3%
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g
| 84 |
| x |
| 58.5 |
| y |
| 44 |
| 4.4g |
x=8.4g
y=5.85g
样品中碳酸氢钠的质量分数=
| 8.4g |
| 10g |
恰好完全反应时,所得溶液中溶质的质量分数=
| 10g-8.4g+5.85g |
| 10g+25.1g-4.4g |
答:(1)样品中碳酸氢钠的质量分数约为84%;
(2)恰好完全反应时,所得溶液中溶质的质量分数为24.3%
点评:反应与图象结合类问题,根据图形分析反应的进程是进行答题的基础,图象出现的拐点为恰好完全反应点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目